Le sulfure de sodium (sulfure) est un composé chimique de formule Na2S. Il est couramment utilisé dans l’industrie du papier et de la pâte à papier ainsi que dans le traitement de l’eau pour éliminer les métaux lourds.
| Nom UICPA | Sulfure de disodium |
| Formule moléculaire | Na2S |
| Numero CAS | 1313-82-2 |
| Synonymes | Sulfure de sodium, monosulfure de sodium, sulfure disodique, sulfure de sodium anhydre, sulfure de sodium nonahydraté, sulfuret de sodium |
| InChI | InChI=1S/2Na.S/q2*+1;-2 |
Masse molaire du sulfure de sodium
Le sulfure de sodium a une masse molaire de 78,045 g/mol. Cela signifie qu’une mole de sulfure de sodium contient 78,045 grammes du composé. La masse molaire est une quantité utile pour calculer la quantité d’une substance nécessaire à une réaction, ainsi que pour déterminer le poids moléculaire d’un composé.
Point d’ébullition du sulfure de sodium
Le sulfure de sodium a un point d’ébullition relativement élevé de >1 180 °C (2 156 °F). Cela signifie qu’il faut une quantité importante d’énergie pour convertir la forme solide du sulfure de sodium en sa forme gazeuse. Le point d’ébullition élevé indique également que le sulfure de sodium est un composé stable à haute température.
Point de fusion du sulfure de sodium
Le sulfure de sodium a un point de fusion de 1 180 °C (2 156 °F). Cela signifie qu’il faut une quantité importante d’énergie pour convertir la forme solide du sulfure de sodium en sa forme liquide. Le point de fusion élevé du sulfure de sodium indique également qu’il s’agit d’un composé stable à haute température.
Densité du sulfure de sodium g/ml
La densité du sulfure de sodium varie selon sa forme. La forme anhydre du sulfure de sodium a une densité de 1,856 g/mL, tandis que la forme nonahydratée a une densité de 1,58 g/mL. La densité d’une substance est la masse par unité de volume et c’est une quantité utile pour déterminer la concentration d’une solution.
Poids moléculaire du sulfure de sodium
Le poids moléculaire du sulfure de sodium est de 78,045 g/mol. Cela signifie qu’une mole de sulfure de sodium contient 6,022 x 10^23 molécules du composé. Le poids moléculaire est une quantité utile pour calculer la quantité d’une substance nécessaire à une réaction, ainsi que pour déterminer la masse molaire d’un composé.
Structure du sulfure de sodium
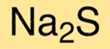
Le sulfure de sodium a une structure cristalline sous sa forme anhydre. Le composé forme des cristaux incolores hautement solubles dans l’eau. La structure du composé est composée de cations sodium (Na+) et d’anions sulfure (S2-). Le composé possède une forte liaison ionique entre les ions sodium et sulfure.
Formule de sulfure de sodium
La formule chimique du sulfure de sodium est Na2S. Cela signifie que chaque molécule de sulfure de sodium contient deux cations sodium et un anion sulfure. La formule est utile pour comprendre la composition chimique du composé et pour déterminer ses propriétés.
| Apparence | Solide jaune à jaune-brun, déliquescent |
| Gravité spécifique | 1,856 (anhydre), 1,58 (nonahydraté) |
| Couleur | Incolore à jaune |
| Odeur | Odeur d’œuf pourri |
| Masse molaire | 78,045 g/mole |
| Densité | 1,856 g/mL (anhydre), 1,58 g/mL (nonahydraté) |
| Point de fusion | 1 180 °C (2 156 °F) |
| Point d’ébullition | >1 180 °C (2 156 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’éthanol, le glycérol |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcalin, pH ~12 |
Sécurité et dangers du sulfure de sodium
Le sulfure de sodium peut présenter plusieurs risques pour la sécurité. Il est très réactif avec l’eau et peut provoquer de graves irritations de la peau et des yeux au contact. L’inhalation du composé peut entraîner une irritation des voies respiratoires et provoquer des nausées, des vomissements et de la diarrhée en cas d’ingestion. Le composé est également hautement inflammable et peut réagir violemment avec les agents oxydants. Il est important de manipuler le sulfure de sodium avec précaution et de porter un équipement de protection approprié, comme des gants et des lunettes. Une ventilation adéquate doit également être assurée lors de la manipulation du composé. En cas d’exposition, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Corrosif, Toxique |
| Description de la sécurité | Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. EN CAS DE CONTACT AVEC LES YEUX : Rincer avec précaution à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez à rincer. EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux) : Enlever immédiatement tous les vêtements contaminés. Rincer la peau à l’eau/douche. EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir. Appeler immédiatement un CENTRE ANTIPOISON ou un médecin. |
| Identifiants ONU | UN1849 |
| Code SH | 2830.10.00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Très toxique ; peut provoquer une grave irritation de la peau et des yeux, une irritation des voies respiratoires, des nausées, des vomissements et de la diarrhée en cas d’ingestion. Peut être mortel en cas d’ingestion. |
Méthodes de synthèse du sulfure de sodium
Plusieurs méthodes existent pour synthétiser le sulfure de sodium :
Une méthode courante consiste à faire réagir l’hydroxyde de sodium (NaOH) avec du soufre (S) dans un four à haute température pour produire du sulfure de sodium (Na2S) et de l’eau (H2O).
Une autre méthode consiste à faire réagir du dioxyde de soufre (SO2) avec du sulfure de sodium (Na2S) pour former du thiosulfate de sodium (Na2S2O3), puis à le faire réagir avec de l’hydroxyde de sodium (NaOH) pour former du sulfure de sodium (Na2S) et de l’eau (H2O).
Une troisième méthode implique la réduction du sulfate de sodium (Na2SO4) avec du carbone en présence de charbon de bois à haute température pour produire du sulfure de sodium (Na2S), du dioxyde de carbone (CO2) et du monoxyde de carbone (CO).
Une autre méthode consiste à faire réagir du carbonate de sodium (Na2CO3) avec du soufre (S) en présence de charbon de bois à haute température pour produire du sulfure de sodium (Na2S), du dioxyde de carbone (CO2) et du monoxyde de carbone (CO).
Pour synthétiser le sulfure de sodium, on peut faire réagir le sulfure de sodium nonahydraté (Na2S.9H2O) avec de l’acide sulfurique (H2SO4) pour produire du sulfate de sodium (Na2SO4) et du dioxyde de soufre (SO2). Ensuite, chauffez le sulfate de sodium avec du charbon de bois pour produire du sulfure de sodium (Na2S) et du dioxyde de carbone (CO2).
Dans l’ensemble, il existe différentes méthodes de synthèse du sulfure de sodium, et le choix d’une méthode particulière dépend de facteurs tels que la pureté souhaitée, la quantité et la rentabilité du produit.
Utilisations du sulfure de sodium
Le sulfure de sodium sert à diverses industries avec un large éventail d’utilisations.
L’industrie du cuir l’utilise couramment comme agent dépilatoire pour éliminer les poils et la laine des cuirs et peaux.
Il est utilisé comme agent de sulfuration pour produire des colorants au soufre pour les textiles et comme agent réducteur dans la fabrication d’autres produits chimiques comme l’hydrosulfite de sodium.
Dans l’industrie des pâtes et papiers, le sulfure de sodium agit comme agent de blanchiment et aide à éliminer la lignine de la pâte de bois.
Il sert également d’agent de flottation dans l’exploitation minière pour séparer les minerais de cuivre, de plomb et de zinc de leur gangue.
Dans l’industrie du traitement des eaux usées, le sulfure de sodium est utilisé comme agent réducteur pour éliminer les métaux lourds des flux d’effluents. De plus, il aide en tant qu’agent de déchloration à éliminer le chlore résiduel dans les processus de traitement de l’eau.
L’industrie pharmaceutique utilise le sulfure de sodium dans la production de certains médicaments et comme agent réducteur dans les réactions de chimie organique.
Les laboratoires l’utilisent comme réactif en chimie analytique et comme source d’ions soufre en synthèse chimique.
Dans l’ensemble, le sulfure de sodium est un composé polyvalent avec diverses applications dans diverses industries. Ses propriétés chimiques uniques le rendent utile comme agent réducteur, agent dépilatoire, agent de flottation et agent de déchloration, entre autres.
Des questions:
Q : Quelle est la charge du cation dans le composé ionique sulfure de sodium ?
R : Le cation du sulfure de sodium est le sodium (Na+), qui a une charge de +1.
Q : Quelle est la formule du sulfure de sodium ?
R : La formule du sulfure de sodium est Na2S, qui représente le composé ionique formé par la combinaison d’un cation sodium (Na+) et d’un anion sulfure (S2-).
Q : Quelle est la formule du sulfure de sodium ?
R : La formule du sulfure de sodium est Na2S, qui représente le composé ionique formé par la combinaison d’un cation sodium (Na+) et d’un anion sulfure (S2-).
Q : Le sulfure de sodium est-il soluble ?
R : Le sulfure de sodium est soluble dans les solvants polaires comme l’eau et l’éthanol, mais il est insoluble dans les solvants non polaires comme le benzène et le chloroforme.
Q : Le sulfure de sodium est-il soluble dans l’eau ?
R : Oui, le sulfure de sodium est hautement soluble dans l’eau, avec une solubilité d’environ 50 g/100 ml à température ambiante. Lorsque le sulfure de sodium est dissous dans l’eau, il subit une hydrolyse pour former de l’hydroxyde de sodium et du sulfure d’hydrogène gazeux.
