Le sulfure de nickel (NiS) est un composé de nickel et de soufre. Il est utilisé dans diverses industries, notamment la céramique et le verre, en raison de ses propriétés et applications uniques.
| Nom UICPA | Sulfure de nickel |
| Formule moléculaire | NiS |
| Numero CAS | 16812-54-7 |
| Synonymes | Sulfure de nickel (II), monosulfure de dinickel, sulfure de nickel |
| InChI | InChI=1S/Ni.S/q+2;-2 |
Propriétés du sulfure de nickel
Formule de sulfure de nickel
La formule chimique du monosulfure de nickel est NiS. Il se compose d’un atome de nickel (Ni) et d’un atome de soufre (S), indiquant un rapport de un pour un entre les deux éléments.
Sulfure De Nickel Masse molaire
La masse molaire du monosulfure de nickel (NiS) est d’environ 90,76 grammes par mole (g/mol). Cette valeur est calculée en additionnant les masses atomiques d’un atome de nickel et d’un atome de soufre.
Point d’ébullition du sulfure de nickel
Le sulfure de nickel n’a pas de point d’ébullition bien défini, car il a tendance à se décomposer avant d’atteindre son point d’ébullition en raison de ses propriétés chimiques. Toutefois, cette décomposition peut se produire à des températures élevées.
Sulfure de nickel Point de fusion
Le point de fusion du monosulfure de nickel est d’environ 797 degrés Celsius (1 467 degrés Fahrenheit). Cette température représente le point auquel le monosulfure de nickel solide passe à l’état liquide.
Densité du sulfure de nickel g/mL
La densité du monosulfure de nickel est d’environ 5,9 grammes par centimètre cube (g/cm³). Cette valeur de densité indique la masse de monosulfure de nickel par unité de volume et est relativement élevée en raison de la disposition compacte de ses atomes.
Poids moléculaire du sulfure de nickel
Le poids moléculaire du monosulfure de nickel (NiS) est d’environ 90,76 g/mol. Cette valeur est déterminée en additionnant les poids atomiques du nickel et du soufre présents dans le composé.
Structure du sulfure de nickel
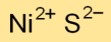
Le monosulfure de nickel peut adopter diverses structures cristallines, notamment des arrangements hexagonaux et cubiques. Ces structures affectent ses propriétés physiques et chimiques, ce qui le rend utile dans différentes applications comme les semi-conducteurs et les catalyseurs.
Solubilité du sulfure de nickel
Le monosulfure de nickel a une solubilité limitée dans l’eau et dans de nombreux autres solvants. Sa solubilité dépend de facteurs tels que la température, le pH et la présence d’autres ions. Généralement, il est considéré comme insoluble dans les solutions aqueuses. Cependant, il peut réagir avec les acides pour former des sels de nickel solubles.
| Apparence | Noir solide |
| Gravité spécifique | 5,9 g/cm³ |
| Couleur | Noir |
| Odeur | Inodore |
| Masse molaire | 90,76 g/mole |
| Densité | 5,9 g/cm³ |
| Point de fusion | 797°C (1467°F) |
| Point d’ébullition | Se décompose à haute température |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité limitée |
| Solubilité | Insoluble dans l’eau, réagit avec les acides pour former des sels de nickel solubles |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du sulfure de nickel
Le monosulfure de nickel présente des risques potentiels pour la sécurité. L’inhalation ou l’ingestion de ses poussières peut entraîner une irritation respiratoire et un inconfort digestif. Le contact avec la peau peut entraîner une irritation ou une dermatite, en particulier chez les personnes sensibles. Une exposition prolongée à des niveaux élevés peut entraîner des problèmes respiratoires plus graves. La combustion ou la décomposition libère des fumées toxiques, nécessitant une ventilation adéquate et un équipement de protection. Une manipulation sécuritaire implique l’utilisation de gants, de lunettes de sécurité et d’une blouse de laboratoire. Éviter tout contact avec les yeux, la peau et les vêtements. En cas d’exposition, rincer les zones touchées avec de l’eau et consulter un médecin si les symptômes persistent. Suivez toujours les consignes de sécurité et travaillez dans des zones bien ventilées.
| Symboles de danger | Irritant, Danger pour la santé |
| Description de la sécurité | Manipuler avec soin. Utilisez un équipement de protection approprié. Évitez tout contact avec la peau, les yeux et l’inhalation de poussière. Travaillez dans des zones bien ventilées. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | N’est pas applicable |
| Classe de danger | Risque environnemental (N) |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Peut provoquer une irritation ; une exposition prolongée à des niveaux élevés peut entraîner des problèmes respiratoires plus graves. |
Méthodes de synthèse du sulfure de nickel
Le monosulfure de nickel peut être synthétisé par diverses méthodes. Une approche courante implique la réaction entre un sel de Ni soluble, comme NiCl2 ou Ni(NO3)2 , et une source de sulfure soluble, telle que le sulfure de sodium ou le sulfure d’hydrogène gazeux. Cette méthode de précipitation donne du monosulfure de nickel solide comme produit.
Une autre méthode est la décomposition thermique des composés du nickel en présence de sources de soufre. Par exemple, le chauffage de sels de nickel comme le carbonate de nickel ou l’hydroxyde de nickel avec du soufre à des températures élevées peut produire du monosulfure de nickel.
Le dépôt chimique en phase vapeur (CVD) est utilisé pour le dépôt de couches minces de monosulfure de nickel. Dans cette méthode, des précurseurs gazeux de nickel et de soufre sont introduits dans un environnement contrôlé, où ils réagissent pour former une fine couche de monosulfure de nickel sur un substrat.
La synthèse hydrothermale consiste à faire réagir des solutions aqueuses de sels de nickel et de composés soufrés à haute température et pression. Cette méthode permet la formation contrôlée de nanoparticules de monosulfure de nickel.
Dans l’ensemble, ces méthodes offrent diverses manières de synthétiser le monosulfure de nickel, répondant à différentes applications et exigences dans des secteurs tels que l’électronique, la catalyse et la science des matériaux.
Utilisations du sulfure de nickel
Le monosulfure de nickel trouve des applications polyvalentes dans tous les secteurs en raison de ses propriétés uniques. Certaines utilisations clés incluent :
- Catalyseurs : Il sert de catalyseur dans diverses réactions chimiques, notamment les processus d’hydrogénation et de désulfuration dans l’industrie pétrolière.
- Semi-conducteurs : les fabricants utilisent le monosulfure de nickel pour créer des semi-conducteurs, en particulier dans les cellules solaires à couches minces, où il sert de composant essentiel au sein de la couche absorbante.
- Verre et céramique : le monosulfure de nickel améliore à la fois la couleur et l’opacité du verre et de la céramique, jouant un rôle crucial dans la production d’objets décoratifs et fonctionnels.
- Matériaux thermoélectriques : les chercheurs étudient le monosulfure de nickel pour ses propriétés thermoélectriques, dans le but d’exploiter sa capacité à convertir les différentiels de chaleur en énergie électrique dans les dispositifs thermoélectriques.
- Électrodes : les batteries rechargeables bénéficient du monosulfure de nickel car il fonctionne comme un matériau d’électrode en raison de sa conductivité électrique et de sa stabilité exceptionnelles.
- Capteurs de gaz : les matériaux à base de monosulfure de nickel jouent un rôle clé dans les capteurs de gaz, permettant la détection de gaz comme l’hydrogène, l’ammoniac et le dioxyde de soufre.
- Médecine : Dans diverses applications médicales, le monosulfure de nickel à l’échelle nanométrique est utilisé pour les systèmes d’administration de médicaments et le traitement du cancer.
- Verre Sulfuré : Il contribue à la formation de verres sulfurés aux propriétés optiques uniques, adaptés à l’optique infrarouge.
- Piles à combustible : les nanoparticules de monosulfure de nickel sont étudiées pour des applications potentielles dans les piles à combustible en raison de leurs propriétés électrocatalytiques.
- Résistance à la corrosion : Lorsqu’il est ajouté aux métaux, il améliore leurs propriétés de résistance à la corrosion.
L’adaptabilité du monosulfure de nickel dans différents secteurs montre sa valeur en contribuant aux progrès des matériaux, de l’électronique, de l’énergie et au-delà.
Des questions:
Q : Quelle est la formule du sulfure de nickel(ii) ?
R : La formule du monosulfure de nickel (II) est NiS.
Q : Le sulfure de nickel est-il soluble ?
R : Le monosulfure de nickel est généralement insoluble dans l’eau.
Q : Le sulfure de nickel ii est-il soluble dans l’eau ?
R : Non, le monosulfure de nickel (II) est insoluble dans l’eau.
Q : Le sulfure de nickel(ii) est-il soluble ou insoluble ?
R : Le monosulfure de nickel (II) est insoluble dans l’eau.
Q : Une réaction se produit-elle lorsque des solutions aqueuses de chlorure de nickel(ii) et de sulfure de sodium sont combinées ?
R : Oui, une réaction se produit, formant du monosulfure de nickel (II) sous forme de précipité solide.
Q : Quelle est la solubilité molaire du sulfure de nickel(ii) dans 0,053 m kcn ?
R : La solubilité molaire du monosulfure de nickel (II) dans 0,053 M KCN est calculée sur la base de constantes d’équilibre spécifiques.
Q : Quel est le résultat d’une réaction entre le nitrate de nickel (iii) et le sulfure de rubidium ?
R : Une réaction entre le nitrate de nickel (III) et le sulfure de rubidium entraîne la formation de produits déterminés par leurs propriétés chimiques respectives.
Q : Comment écrire une formule quand se trouve le sulfure de nickel (ii) ?
R : La formule du monosulfure de nickel (II) est NiS.
