Le sulfite de potassium (K2SO3) est un composé chimique composé de potassium, de soufre et d’oxygène. Il est couramment utilisé comme conservateur dans l’industrie alimentaire pour prévenir la décoloration et la détérioration.
| Nom UICPA | Sulfite de potassium |
| Formule moléculaire | K2SO3 |
| Numero CAS | 10117-38-1 |
| Synonymes | Sulfite dipotassique ; Sel dipotassique de l’acide sulfureux ; Sulfonate de potassium ; Oxyde de soufre et de potassium |
| InChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Sulfite de Potassium
Formule de sulfite de potassium
Le sulfite de potassium a la formule chimique K2SO3, ce qui indique qu’il contient deux atomes de potassium, un atome de soufre et trois atomes d’oxygène. Le composé est formé par la réaction entre l’hydroxyde de potassium (KOH) et le dioxyde de soufre (SO2). Le sulfite de potassium est un composé ionique, ce qui signifie qu’il est composé d’ions potassium chargés positivement et d’ions sulfite chargés négativement. La formule de l’ion sulfite est SO32-.
Sulfite De Potassium Masse molaire
La masse molaire du K2SO3 est de 158,26 g/mol. Ceci est calculé en additionnant les masses atomiques de chaque élément dans la formule (2 x masse atomique de K) + masse atomique de S + (3 x masse atomique de O). La masse molaire d’un composé est importante car elle aide à calculer la quantité de composé nécessaire pour une réaction donnée ou à déterminer la concentration d’une solution.
Point d’ébullition du sulfite de potassium
Le K2SO3 n’a pas de point d’ébullition spécifique car il se décompose avant d’atteindre son point d’ébullition. Cependant, lorsqu’il est chauffé, le K2SO3 subit une décomposition thermique pour former du sulfate de potassium (K2SO4) et du dioxyde de soufre (SO2). La température de décomposition est d’environ 390°C.
Sulfite de Potassium Point de fusion
Le point de fusion du K2SO3 est d’environ 350°C. A cette température, le composé solide se transforme en liquide. Cependant, à mesure que la température augmente, le K2SO3 se décompose, comme mentionné précédemment.
Densité du sulfite de potassium g/mL
La densité du K2SO3 est de 2,44 g/mL à température ambiante. La densité est définie comme la masse d’une substance par unité de volume. La densité élevée du K2SO3 indique qu’il s’agit d’un composé relativement lourd. Cette propriété est importante pour déterminer les propriétés physiques du composé, telles que sa solubilité et sa réactivité.
Sulfite De Potassium Poids moléculaire
Le poids moléculaire du K2SO3 est de 158,26 g/mol. Cette valeur représente la masse moyenne d’une molécule du composé. Le poids moléculaire est important pour calculer la quantité d’une substance dans un volume ou une masse donnée, ce qui est utile dans les réactions chimiques et les expériences en laboratoire.
Structure du sulfite de potassium
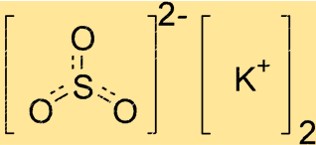
K2SO3 a une structure cristalline, ce qui signifie que ses atomes sont disposés selon un motif répétitif. Le composé a une géométrie planaire trigonale, avec l’atome de soufre au centre et les trois atomes d’oxygène disposés symétriquement autour de lui. Les ions potassium sont situés à l’extérieur de cette structure, équilibrant la charge négative des ions sulfite.
Solubilité du sulfite de potassium
Le K2SO3 est hautement soluble dans l’eau. À température ambiante, il peut se dissoudre dans l’eau pour former une solution claire et incolore. La solubilité du K2SO3 est due à sa nature ionique, qui lui permet de se dissocier en ses ions constitutifs dans l’eau. La solubilité du K2SO3 est également affectée par la température, la solubilité augmentant à mesure que la température augmente.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2.44 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 158,26 g/mole |
| Densité | 2,44 g/ml |
| Point de fusion | 350°C |
| Point d’ébullition | Se décompose à 390°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol et le glycérol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 10,3 (pour l’acide sulfureux) |
| pH | ~9 (pour une solution 0,1 M) |
Sécurité et dangers du sulfite de potassium
Le K2SO3 est relativement sûr à manipuler et à utiliser si les précautions appropriées sont prises. Cependant, il peut présenter des dangers s’il n’est pas manipulé avec précaution. Le composé peut provoquer une irritation de la peau, des yeux et du système respiratoire s’il entre en contact avec ces parties du corps. Le K2SO3 peut également provoquer des problèmes gastro-intestinaux en cas d’ingestion. De plus, le composé présente un risque potentiel d’incendie et d’explosion lorsqu’il est exposé à la chaleur ou aux flammes. Par conséquent, des mesures de sécurité appropriées doivent être prises lorsque vous travaillez avec du K2SO3, telles que le port d’un équipement de protection et le stockage du composé à l’écart de la chaleur et des sources d’inflammation.
| Symboles de danger | Crâne et os croisés |
| Description de la sécurité | Toxique, nocif en cas d’ingestion, irritant pour la peau et les yeux |
| Numéros d’identification de l’ONU | ONU 2697 |
| Code SH | 283210 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II (Danger moyen) |
| Toxicité | Orale (DL50) : 345 mg/kg (rat) |
Méthodes de synthèse du sulfite de potassium
Le K2SO3 peut être synthétisé par différentes méthodes, notamment la réaction de l’hydroxyde de potassium avec du dioxyde de soufre ou du soufre, la réaction du carbonate de potassium avec du dioxyde de soufre et la réaction du bisulfite de potassium avec l’hydroxyde de potassium.
Dans la première méthode, une solution d’ hydroxyde de potassium réagit avec du dioxyde de soufre gazeux en présence d’eau pour former du K2SO3. Dans la deuxième méthode, un mélange de carbonate de potassium et de dioxyde de soufre est chauffé à haute température pour produire du K2SO3. La troisième méthode consiste à mélanger du bisulfite de potassium avec de l’hydroxyde de potassium pour produire du K2SO3 et de l’eau.
Une autre méthode courante de synthèse du K2SO3 est la réaction du dioxyde de soufre avec un sel de potassium, tel que le chlorure de potassium, en présence d’agents réducteurs comme l’hydrosulfite de sodium ou le sulfate de fer (II). Cette méthode est souvent utilisée en milieu industriel pour produire de grandes quantités de K2SO3.
Utilisations du sulfite de potassium
Le K2SO3 a plusieurs applications dans différentes industries en raison de ses propriétés chimiques. Voici quelques utilisations courantes du K2SO3 :
- Industrie alimentaire et des boissons : utilisé comme conservateur alimentaire pour prévenir la détérioration et la décoloration des aliments tels que le vin, les fruits secs et les crevettes.
- Photographie : utilisé comme agent de fixation photographique pour empêcher le développement ultérieur du film et rendre l’image permanente.
- Traitement de l’eau : Utilisé comme agent réducteur pour éliminer le chlore de l’eau et pour traiter les eaux usées.
- Industrie du papier : Utilisé comme agent de blanchiment pour éliminer les impuretés et blanchir la pâte dans le processus de fabrication du papier.
- Industrie textile : Utilisé comme agent réducteur pour éliminer l’excès de colorant des tissus et pour blanchir les textiles.
- Industrie chimique : utilisé comme agent réducteur dans les réactions chimiques pour convertir les agents oxydants en agents réducteurs.
- Industrie médicinale : Utilisé dans certains traitements médicaux pour prévenir ou soulager les symptômes de certaines conditions.
Des questions:
Q : Quelle est la formule du sulfite de potassium ?
R : La formule du sulfite de potassium est K2SO3.
Q : Le sulfate de potassium est-il un sulfite ?
R : Non, le sulfate de potassium n’est pas un sulfite. C’est un sel composé de potassium, de soufre et d’oxygène de formule chimique K2SO4.
Q : Quel sel est produit lorsque H2SO4 réagit avec NaOH ? K2SO3, Na2SO4, Na2SO3, K2SO4
R : Lorsque H2SO4 réagit avec NaOH, le sel produit est Na2SO4.
Q : Combien d’ions SO32- sont contenus dans 99,6 mg de Na2SO3 ?
La masse molaire de Na2SO3 est de 126,05 g/mol. R : Pour calculer le nombre d’ions SO32-, nous devons d’abord trouver le nombre de moles de Na2SO3 : 99,6 mg / 126,05 g/mol = 0,000789 mol. Puisque Na2SO3 contient deux ions SO32- par molécule, le nombre d’ions SO32- dans 0,000789 mole de Na2SO3 est de 0,000789 mol x 2 = 0,00158 mol. Par conséquent, il y a 0,00158 mol x 6,022 x 10^23 ions/mol = 9,52 x 10^20 ions SO32- dans 99,6 mg de Na2SO3.
Q : Combien d’ions sodium sont contenus dans 99,6 mg de Na2SO3 ? La masse molaire de Na2SO3 est de 126,05 g/mol.
R : Pour calculer le nombre d’ions sodium, nous devons d’abord trouver le nombre de moles de Na2SO3 : 99,6 mg / 126,05 g/mol = 0,000789 mol. Puisque chaque molécule de Na2SO3 contient deux ions sodium, le nombre d’ions sodium dans 0,000789 mole de Na2SO3 est de 0,000789 mol x 2 = 0,00158 mol. Par conséquent, il y a 0,00158 mol x 6,022 x 10^23 ions/mol = 9,52 x 10^20 ions sodium dans 99,6 mg de Na2SO3.
Q : Quel est le nom chimique du Na2SO3 ?
R : Le nom chimique du Na2SO3 est sulfite de sodium.
Q : Quel est le nom du composé de formule Na2SO3 ?
R : Le nom du composé de formule Na2SO3 est sulfite de sodium.
