Le sulfite de calcium (CaSO3) est un composé qui contient des ions Ca2+ et SO32-. Il est souvent utilisé comme conservateur alimentaire, antioxydant et purificateur d’eau en raison de sa capacité à éliminer les impuretés et à prévenir la détérioration.
| Nom UICPA | Sulfite de calcium |
| Formule moléculaire | CaSO3 |
| Numero CAS | 10257-55-3 |
| Synonymes | Sulfite de calcium; Acide sulfureux, sel de calcium ; Acide sulfureux de calcium ; Acide sulfureux de calcium ; E226 |
| InChI | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriétés du sulfite de calcium
Formule de sulfite de calcium
La formule chimique du sulfite de calcium est CaSO3. Ce composé est composé d’un ion Ca2+ et d’un ion SO32-. Le sulfite de calcium peut être préparé en faisant réagir de l’hydroxyde de calcium avec de l’acide sulfureux. Il est couramment utilisé dans l’industrie alimentaire comme conservateur et antioxydant, ainsi que comme purificateur d’eau.
Sulfite De Calcium Masse molaire
La masse molaire de CaSO3 est de 120,14 g/mol. Cela peut être calculé en additionnant les masses atomiques de calcium (40,08 g/mol), de soufre (32,06 g/mol) et de trois atomes d’oxygène (16,00 g/mol chacun).
Point d’ébullition du sulfite de calcium
Le CaSO3 n’a pas de point d’ébullition bien défini, car il se décompose avant d’atteindre son point d’ébullition. Cependant, il peut être chauffé à une température d’environ 450°C avant que sa décomposition ne se produise. Cela est dû au fait que le CaSO3 est un composé instable et a tendance à se décomposer en sulfate de calcium et en dioxyde de soufre lorsqu’il est chauffé.
Sulfite de Calcium Point de fusion
Le point de fusion du CaSO3 est d’environ 1 520°C. C’est la température à laquelle le composé solide passe à l’état liquide. Le CaSO3 a une structure cristalline et fond à haute température en raison des fortes liaisons ioniques entre les ions calcium et sulfite.
Densité du sulfite de calcium g/mL
La densité du CaSO3 est d’environ 2,71 g/mL. Cela signifie qu’un millilitre de CaSO3 a une masse de 2,71 grammes. La densité élevée du CaSO3 est due à la présence de l’ion calcium, qui possède une masse atomique élevée.
Sulfite De Calcium Poids moléculaire
Le poids moléculaire du CaSO3 est de 120,14 g/mol. Ceci peut être calculé en additionnant les poids atomiques du calcium, du soufre et de trois atomes d’oxygène dans le composé. Le poids moléculaire du CaSO3 est important pour déterminer ses propriétés physiques et chimiques.
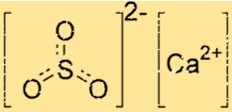
Structure du sulfite de calcium
La structure du CaSO3 se compose d’un ion Ca2+ et d’un ion SO32-. L’ion calcium est entouré de six atomes d’oxygène, tandis que l’ion sulfite possède deux atomes d’oxygène et un atome de soufre. L’ion Ca2+ et l’ion SO32- sont maintenus ensemble par des liaisons ioniques, qui sont de fortes forces d’attraction électrostatiques entre des ions de charges opposées.
Solubilité du sulfite de calcium
Le CaSO3 est peu soluble dans l’eau, avec une solubilité d’environ 0,17 g/100 mL à température ambiante. Cela signifie que seule une petite quantité de CaSO3 peut se dissoudre dans l’eau et que les particules solides restantes resteront en suspension dans l’eau. La solubilité du CaSO3 est affectée par des facteurs tels que la température, le pH et la présence d’autres ions.
| Apparence | Poudre blanche ou solide cristallin |
| Gravité spécifique | 2,71 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 120,14 g/mole |
| Densité | 2,71 g/ml |
| Point de fusion | 1 520 °C |
| Point d’ébullition | Se décompose avant d’atteindre le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble, env. 0,17 g/100 mL à température ambiante. |
| Solubilité | Insoluble dans l’alcool et l’éther |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 1,91 |
| pH | Légèrement basique (pH 8-9 une fois dissous dans l’eau) |
Sécurité et dangers du sulfite de calcium
Le CaSO3 est généralement considéré comme sûr pour une utilisation dans les applications de traitement des aliments et de l’eau. Cependant, comme tout produit chimique, il peut présenter certains dangers s’il n’est pas manipulé correctement. Le CaSO3 est un irritant pour la peau et les yeux et peut provoquer une irritation respiratoire en cas d’inhalation. L’ingestion de grandes quantités de CaSO3 peut provoquer des nausées, des vomissements et de la diarrhée. Lors de la manipulation du CaSO3, il convient de prendre des mesures de sécurité appropriées, telles que le port de gants et de lunettes de protection. Il faut consulter immédiatement un médecin s’il entre en contact avec du CaSO3 sur la peau, les yeux ou s’il l’ingère. Il est également important de suivre les procédures appropriées de stockage et d’élimination du CaSO3 afin de minimiser les dangers potentiels.
| Symboles de danger | Aucun attribué |
| Description de la sécurité | Evitez le contact avec les yeux, la peau et les vêtements. Porter des gants et des lunettes de protection lors de la manipulation. En cas de contact, rincer les zones touchées à l’eau. En cas d’ingestion, consulter immédiatement un médecin. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 283210 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Le sulfite de calcium est considéré comme non toxique à faibles concentrations, mais peut provoquer une irritation gastro-intestinale et d’autres effets sur la santé à fortes doses. |
Méthodes de synthèse du sulfite de calcium
La réaction de l’acide sulfureux avec l’hydroxyde de calcium peut synthétiser du CaSO3. La réaction produit du CaSO3 et de l’eau comme sous-produits.
Une autre méthode consiste à faire réagir du carbonate de calcium avec de l’acide sulfureux, ce qui produit du CaSO3, de l’eau et du dioxyde de carbone. Généralement, les chimistes effectuent la réaction dans une solution aqueuse à température ambiante ou légèrement supérieure.
Dans une autre méthode, la réaction de l’oxyde de calcium avec du dioxyde de soufre, puis l’ajout d’eau au produit résultant produisent du CaSO3.
En milieu industriel, l’absorption de dioxyde de soufre dans une suspension d’ hydroxyde de calcium produit généralement du CaSO3. Ce processus produit un mélange de CaSO3 et de sulfate de calcium, qui peut être séparé par filtration ou par d’autres méthodes. On peut utiliser le CaSO3 résultant dans diverses applications, notamment le traitement de l’eau et comme conservateur alimentaire.
Dans l’ensemble, il existe plusieurs méthodes de synthèse du CaSO3, chacune ayant ses propres avantages et limites en fonction de l’application spécifique et de la pureté souhaitée du produit final.
Utilisations du sulfite de calcium
Le CaSO3 a diverses utilisations dans différentes industries en raison de ses propriétés uniques. Certaines utilisations courantes du CaSO3 comprennent :
- Traitement de l’eau : Souvent utilisé comme agent de traitement de l’eau pour éliminer les impuretés et désinfecter l’eau. Il peut éliminer efficacement le chlore, les métaux lourds et autres contaminants de l’eau.
- Conservation des aliments : utilisé comme conservateur alimentaire pour éviter la détérioration et prolonger la durée de conservation des produits alimentaires. Couramment utilisé dans la production d’aliments en conserve et en bouteille, ainsi que dans la fabrication du vin et de la bière.
- Industrie chimique : Utilisé dans l’industrie chimique comme agent réducteur et dans la production d’acide sulfurique.
- Construction : Utilisé comme composant de matériaux de construction tels que les cloisons sèches et le ciment.
- Industrie agricole : Utilisé en agriculture pour traiter les sols et prévenir les maladies des plantes.
- Applications médicales : Également utilisé dans des applications médicales comme antioxydant et comme traitement pour certaines conditions médicales.
Des questions:
Q : Quelle est la formule du sulfite de calcium ?
R : La formule du sulfite de calcium est CaSO3.
Q : Quel est l’état du sulfite de calcium ?
R : Le CaSO3 est un solide à température ambiante.
Q : Combien de grammes de calcium y a-t-il dans 3,36 grammes de CaSO3 ?
R : Il y a environ 1,14 gramme de calcium présent dans 3,36 grammes de CaSO3.
Q : Que se passe-t-il lorsque vous ajoutez du carbonate de calcium à de l’acide chlorhydrique et du sulfite de sodium ?
R : Lorsque du carbonate de calcium est ajouté à l’acide chlorhydrique et au sulfite de sodium, une réaction se produit qui produit du CaSO3, de l’eau, du dioxyde de carbone et du chlorure de sodium.
Q : Le sulfite de calcium se dissout-il dans l’eau ?
R : Oui, le CaSO3 est légèrement soluble dans l’eau.
Q : Y a-t-il du sulfite de calcium dans l’eau de ville ?
R : Le CaSO3 n’est pas couramment trouvé dans l’eau de ville, mais il peut être utilisé dans les processus de traitement de l’eau pour éliminer les impuretés.
Q : Le CaSO3 peut-il être éliminé de l’eau potable ?
R : Oui, le CaSO3 peut être éliminé de l’eau potable par diverses méthodes telles que la filtration, l’osmose inverse ou le traitement chimique.
Q : Que produisent le CaSO3 et le HCl ?
R : Lorsque du CaSO3 est ajouté à l’acide chlorhydrique, une réaction se produit qui produit du chlorure de calcium, du dioxyde de soufre gazeux et de l’eau.
