Le sulfate de fer (ii) est un composé chimique contenant des ions fer et sulfate. Il est couramment utilisé dans le traitement de l’eau et comme complément nutritif pour les plantes.
| Nom UICPA | Sulfate de fer (II) |
| Formule moléculaire | FeSO4 |
| Numero CAS | 7720-78-7 |
| Synonymes | Sulfate ferreux, sulfate de fer, vitriol vert, mélantérite, szomolnokite |
| InChI | InChI=1S/Fe.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriétés du sulfate de fer (ii)
Formule de sulfate de fer (II)
La formule chimique du sulfate de fer (II) est FeSO4. Cette formule indique que le sulfate ferreux est constitué d’un atome de fer, d’un atome de soufre et de quatre atomes d’oxygène. La formule du sulfate ferreux est un paramètre important pour calculer diverses propriétés physiques et chimiques du composé, telles que la masse molaire et le poids moléculaire.
Fer(II) Sulfate Masse molaire
La masse molaire du sulfate ferreux est de 151,91 g/mol. Cette valeur représente la masse d’une mole de sulfate ferreux, qui contient 1 atome de fer, 1 molécule de soufre et 4 molécules d’oxygène. La masse molaire est un paramètre important pour calculer diverses propriétés physiques et chimiques du sulfate ferreux, telles que la densité et la concentration.
Point d’ébullition du sulfate de fer (II)
Le sulfate ferreux n’a pas de point d’ébullition spécifique car il subit une décomposition avant d’atteindre son point d’ébullition. A pression atmosphérique, il commence à se décomposer vers 300°C. Cette décomposition implique la perte d’eau et de trioxyde de soufre, laissant derrière elle de l’oxyde de fer (III). Ce comportement de décomposition limite l’utilisation du sulfate ferreux dans les applications à haute température.
Sulfate de fer(II) Point de fusion
Le point de fusion du sulfate ferreux dépend du degré d’hydratation. Le sulfate ferreux anhydre fond à 695°C, tandis que la forme heptahydratée fond à 64°C. Le sulfate ferreux peut exister sous plusieurs formes hydratées différentes, chacune ayant un point de fusion différent. Le point de fusion du sulfate ferreux est un paramètre important pour déterminer les meilleures conditions de préparation et de manipulation du composé.
Densité du sulfate de fer (II) g/mL
La densité du sulfate ferreux varie en fonction du degré d’hydratation. Le sulfate ferreux anhydre a une densité de 3,65 g/mL, tandis que la forme heptahydratée a une densité de 1,897 g/mL. La densité du sulfate ferreux est un paramètre important pour calculer le volume d’une masse donnée du composé.
Fer(II) Sulfate Poids moléculaire
Le poids moléculaire du sulfate ferreux est de 151,91 g/mol. Cette valeur représente la somme des poids atomiques des atomes constitutifs d’une molécule de sulfate ferreux. Le poids moléculaire est un paramètre important pour calculer diverses propriétés physiques et chimiques du sulfate ferreux, telles que le point d’ébullition et la solubilité.
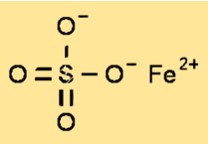
Structure du sulfate de fer (II)
Le sulfate ferreux a une structure cristalline qui appartient au système monoclinique. La structure cristalline du sulfate ferreux est constituée de cations de fer (II) entourés de six molécules d’eau et d’anions sulfate. La structure cristalline du sulfate ferreux est un paramètre important pour comprendre les propriétés physiques et chimiques du composé.
| Apparence | Poudre cristalline blanche ou vert pâle |
| Gravité spécifique | 3,65 g/cm3 (anhydre) |
| Couleur | Vert pâle |
| Odeur | Inodore |
| Masse molaire | 151,91 g/mole |
| Densité | 3,65 g/cm3 (anhydre), 1,89 g/cm3 (heptahydraté) |
| Point de fusion | 695°C (anhydre), 64°C (heptahydraté) |
| Point d’ébullition | Se décompose avant d’atteindre le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, insoluble dans l’éthanol |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | 4 (solution 0,1M) |
Sécurité et dangers du sulfate de fer (ii)
Le sulfate ferreux peut présenter certains dangers pour la santé et la sécurité humaines. Il peut provoquer une irritation et une rougeur de la peau et des yeux au contact, et l’inhalation de ses poussières peut provoquer une irritation des voies respiratoires. L’ingestion peut entraîner des douleurs abdominales, des nausées, des vomissements et de la diarrhée. De plus, l’exposition au sulfate ferreux peut provoquer de l’asthme professionnel et une pneumopathie d’hypersensibilité chez les personnes sensibles. Il est important de suivre les procédures de manipulation et de stockage appropriées, de porter un équipement de protection individuelle approprié et d’éviter d’inhaler ou d’ingérer le composé. En cas d’exposition accidentelle, consulter immédiatement un médecin et consulter la fiche de données de sécurité pour obtenir des conseils.
| Symboles de danger | Xn,N |
| Description de la sécurité | Tenir à l’écart de l’humidité, des acides et des agents oxydants. Évitez tout contact avec la peau, les yeux et les vêtements. Ne pas ingérer. Utiliser avec une ventilation adéquate. Se laver soigneusement les mains après manipulation. |
| Numéros d’identification de l’ONU | UN3077, UN1376 |
| Code SH | 2833.29.90 |
| Classe de danger | 9 (marchandises dangereuses diverses) |
| Groupe d’emballage | III |
| Toxicité | Nocif en cas d’ingestion, provoque une irritation de la peau et des yeux, peut provoquer une irritation des voies respiratoires. Peut entraîner une sensibilisation par inhalation ou par contact avec la peau. |
Méthodes de synthèse du sulfate de fer (ii)
Plusieurs méthodes existent pour synthétiser le sulfate ferreux.
Une méthode courante implique la réaction de la limaille de fer avec de l’acide sulfurique en présence d’eau et d’oxygène. Cela produit une solution de sulfate ferreux heptahydraté, qui peut être davantage purifiée par cristallisation.
Une autre méthode implique la réaction de l’oxyde de fer avec l’acide sulfurique à haute température, suivie du refroidissement et de la filtration de la solution résultante.
Un agent réducteur, tel que de la poudre de fer ou du dioxyde de soufre, peut réduire le sulfate de fer (III) pour obtenir du sulfate ferreux. Cela produit du sulfate ferreux et de l’acide sulfurique . Pour préparer du sulfate ferreux, on peut faire réagir le fer avec du dioxyde de soufre et de l’oxygène en présence d’eau.
Une autre méthode implique la réaction du fer avec de l’acide sulfurique dilué en présence de peroxyde d’hydrogène . Cela produit du sulfate ferreux et de l’eau.
Utilisations du sulfate de fer (ii)
Le sulfate de fer (II) a un large éventail d’applications dans diverses industries, notamment :
- Traitement de l’eau : Couramment utilisé dans le traitement de l’eau pour éliminer les impuretés, telles que le sulfure d’hydrogène, de l’eau.
- Engrais : Utilisés dans la production d’engrais pour fournir aux plantes des nutriments essentiels en fer.
- Production de pigments : utilisé comme précurseur pour produire divers pigments d’oxyde de fer, tels que les pigments jaunes et bruns.
- Suppléments nutritionnels : Utilisé comme supplément nutritionnel pour traiter l’anémie ferriprive chez les humains et les animaux.
- Traitement des eaux usées : utilisé dans le traitement des eaux usées pour éliminer le phosphate et d’autres contaminants.
- Production d’encre : utilisé dans la production d’encre comme agent de noircissement.
- Agents de préservation du bois : Utilisés comme agents de préservation du bois pour protéger le bois des attaques de champignons et d’insectes.
- Réactif de laboratoire : utilisé comme réactif de laboratoire dans diverses réactions et analyses chimiques.
Des questions:
Le sulfate de fer est-il soluble dans l’eau ?
R : Le sulfate de fer, également connu sous le nom de sulfate ferreux, est modérément soluble dans l’eau.
Q : Quelle est la formule du composé sulfate de fer(ii) ?
R : La formule du sulfate ferreux est FeSO4.
Q : Quelle est la formule chimique du sulfate de fer (ii) ?
R : La formule chimique du sulfate ferreux est FeSO4.
Q : Quel est le pourcentage de soufre dans le sulfate de fer(ii) ?
R : Le pourcentage de soufre dans le sulfate ferreux est de 18,5 %.
Q : Le sulfate de fer(ii) est-il soluble dans l’eau ?
R : Oui, le sulfate de fer II, également connu sous le nom de sulfate ferreux, est soluble dans l’eau.
Q : Qu’est-ce que le sulfate ferreux ?
R : Le sulfate ferreux est un autre nom pour le sulfate ferreux, un composé chimique couramment utilisé dans diverses industries.
Q : À quoi sert le sulfate ferreux ?
R : Le sulfate ferreux est utilisé à diverses fins, notamment le traitement de l’eau, la production d’engrais, la production de pigments, les suppléments nutritionnels, la production d’encre, les produits de préservation du bois et les réactifs de laboratoire.
