Le sulfate de zinc est un composé de formule chimique ZnSO4. Il est couramment utilisé comme complément alimentaire pour traiter les carences en zinc et comme engrais pour les cultures.
| Nom UICPA | Sulfate de zinc |
| Formule moléculaire | ZnSO4 |
| Numero CAS | 7733-02-0 |
| Synonymes | Vitriol blanc, Vitriol de zinc, Sulfate de zinc(II), Sulfate de zinc(2+), Monosulfate de zinc, Sulfate de zinc heptahydraté, Sulfate de zinc monohydraté |
| InChI | InChI=1S/2O.H2S.Zn/h2*1H;1H2;/q;;;+2/p-2 |
Formule de sulfate de zinc
La formule chimique du sulfate de zinc est ZnSO4. Il se compose d’un ion zinc (Zn2+) et d’un ion sulfate (SO42-). La formule montre que le sulfate de zinc contient un atome de zinc, un atome de soufre et quatre atomes d’oxygène.
Masse molaire de Sulfate de Zinc
La masse molaire de Sulfate de Zinc (ZnSO4) est 161,44 g/mol. C’est la somme des masses atomiques de tous les atomes présents dans une mole du composé. Le sulfate de zinc est composé d’un atome de zinc (Zn), d’un atome de soufre (S) et de quatre atomes d’oxygène (O). La masse molaire est un paramètre essentiel utilisé dans les calculs de stœchiométrie pour déterminer la quantité de réactifs et de produits dans une réaction chimique.
Point d’ébullition du sulfate de zinc
Le sulfate de zinc n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. Le composé subit une décomposition thermique à environ 680 °C, formant des gaz d’oxyde de zinc (ZnO), de dioxyde de soufre (SO2) et d’oxygène (O2). La température de décomposition est affectée par la présence d’impuretés, la pression et la vitesse de chauffage. Le sulfate de zinc est stable à basse température et est soluble dans l’eau, le méthanol et l’éthanol.
Point de fusion du sulfate de zinc
Le point de fusion du sulfate de zinc dépend du niveau d’hydratation du composé. Le sulfate de zinc heptahydraté (ZnSO4.7H2O) a un point de fusion de 100 °C, tandis que le sulfate de zinc monohydraté (ZnSO4.H2O) fond à 70 °C. Le sulfate de zinc anhydre (ZnSO4) se décompose avant de fondre. Le point de fusion est influencé par des facteurs tels que la pression, la pureté et la vitesse de chauffage.
Densité du sulfate de zinc g/ml
La densité du sulfate de zinc varie en fonction de son état d’hydratation. Le sulfate de zinc heptahydraté a une densité de 1,957 g/cm³, le sulfate de zinc monohydraté a une densité de 3,08 g/cm³ et le sulfate de zinc anhydre a une densité de 3,54 g/cm³. La densité est une propriété physique qui détermine la quantité de masse par unité de volume d’une substance. La densité du sulfate de zinc est également affectée par la température et la pression.
Poids moléculaire du sulfate de zinc
Le poids moléculaire du sulfate de zinc est de 161,44 g/mol. Il est calculé en additionnant les poids atomiques du zinc, du soufre et de l’oxygène, qui sont respectivement de 65,38 g/mol, 32,06 g/mol et 63,998 g/mol. Le poids moléculaire est utilisé dans divers calculs tels que la détermination de la concentration de solutions de sulfate de zinc dans des expériences de chimie et de biologie.
Structure du sulfate de zinc
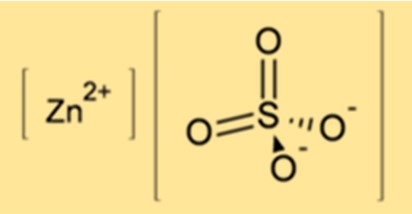
Le sulfate de zinc a une structure cristalline sous sa forme anhydre, avec des cations zinc (Zn2+) et des anions sulfate (SO42-) disposés en alternance. Le cation zinc est coordonné par six atomes d’oxygène provenant de six anions sulfate, formant une géométrie octaédrique déformée. Sous forme hydratée, le sulfate de zinc heptahydraté forme des cristaux monocliniques, tandis que le sulfate de zinc monohydraté forme des cristaux orthorhombiques. Les molécules d’eau contenues dans les hydrates sont faiblement liées au réseau de sulfate de zinc par liaison hydrogène.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 3,54 g/cm³ (anhydre) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 161,44 g/mole |
| Densité | 1,957 g/cm³ (heptahydraté), 3,08 g/cm³ (monohydrate), 3,54 g/cm³ (anhydre) |
| Point de fusion | 70 °C (monohydraté), 100 °C (heptahydraté) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, le méthanol et l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | pKa1=1,9, pKa2=3,1, pKa3=9,8 |
| pH | Le pH de la solution 0,1 M est de 4,2 |
Sécurité et dangers du sulfate de zinc
Le sulfate de zinc est généralement sans danger à manipuler lorsqu’il est utilisé selon les instructions. Cependant, il peut provoquer une irritation des yeux, de la peau et du système respiratoire au contact. L’ingestion de grandes quantités peut entraîner des nausées, des vomissements et de la diarrhée. Une exposition à long terme à la poussière de sulfate de zinc peut provoquer une irritation respiratoire ou une fièvre des fondeurs. Il est important de porter un équipement de protection individuelle (EPI) approprié tel que des gants et des lunettes lors de la manipulation du sulfate de zinc. En cas d’exposition accidentelle, rincer abondamment à l’eau les zones touchées et consulter un médecin si nécessaire. Conservez le sulfate de zinc dans un récipient hermétiquement fermé et à l’écart des substances incompatibles.
| Symboles de danger | XI |
| Description de la sécurité | Tenir hors de portée des enfants. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. EN CAS DE CONTACT AVEC LES YEUX : Rincer avec précaution à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez à rincer. EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir. Obtenez un avis/une attention médicale si vous ne vous sentez pas bien. Éliminer le contenu/récipient conformément aux réglementations locales/régionales/nationales/internationales. |
| Identifiants ONU | Non réglementé |
| Code SH | 2833.29.90 |
| Classe de danger | 9 – Marchandises dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | Le sulfate de zinc est généralement considéré comme ayant une faible toxicité. Cependant, l’ingestion de grandes quantités peut provoquer une irritation gastro-intestinale et entraîner des vomissements, de la diarrhée et une déshydratation. L’inhalation de poussière ou de brouillard peut irriter les voies respiratoires. Le sulfate de zinc peut provoquer une irritation des yeux et de la peau au contact. Une exposition prolongée à des niveaux élevés de poussière de sulfate de zinc peut entraîner la fièvre des fondeurs. |
Méthodes de synthèse du sulfate de zinc
Il existe plusieurs méthodes de synthèse du sulfate de zinc, en fonction de la pureté, de la taille des particules et du niveau d’hydratation souhaités du produit final. Une méthode courante implique la réaction du zinc métallique ou de l’oxyde de zinc avec l’acide sulfurique :
1. Zinc métal + acide sulfurique → sulfate de zinc + hydrogène gazeux
2. Oxyde de zinc + acide sulfurique → Sulfate de zinc + eau
Pour optimiser le rendement et la pureté du sulfate de zinc, il faut effectuer la réaction dans des conditions contrôlées de température, d’agitation et de concentration d’acide. Après cela, appliquez d’autres étapes de traitement telles que la cristallisation, le séchage et le tamisage à la solution de sulfate de zinc résultante pour obtenir la taille de particule et le niveau d’hydratation souhaités.
Une autre méthode de production de sulfate de zinc implique la réaction du minerai ou du concentré de zinc avec l’acide sulfurique :
3. Minerai/concentré de zinc + acide sulfurique → sulfate de zinc + sulfate de fer + eau
On peut séparer le sulfate de zinc du sulfate de fer et d’autres impuretés en utilisant des techniques telles que la filtration, la précipitation ou l’extraction par solvant.
Pour produire du sulfate de zinc, on peut réagir avec du carbonate de zinc ou de l’hydroxyde de zinc avec de l’acide sulfurique, ou oxyder des cendres de zinc avec de l’acide sulfurique.
Le choix de la méthode dépend de facteurs tels que la disponibilité des matières premières, le coût et les spécifications du produit.
Utilisations du sulfate de zinc
Le sulfate de zinc a une large gamme d’applications industrielles, agricoles et médicales en raison de ses propriétés uniques. Voici quelques utilisations courantes du sulfate de zinc :
- Engrais : utilisé comme engrais micronutriment qui fournit du zinc essentiel aux plantes pour une croissance et un développement sains.
- Alimentation animale : ajouté à l’alimentation animale comme complément nutritionnel pour prévenir la carence en zinc et améliorer la santé globale.
- Traitement de l’eau : Utilisé dans les usines de traitement de l’eau pour éliminer les impuretés et réduire la turbidité.
- Galvanisation : utilisée dans le processus de galvanisation, qui consiste à recouvrir le fer et l’acier d’une couche de zinc pour éviter la corrosion.
- Médecine : Utilisé en médecine comme complément alimentaire pour traiter la carence en zinc, ainsi que dans les onguents topiques pour traiter les affections cutanées telles que l’eczéma et l’acné.
- Teinture : utilisée dans la teinture et l’impression de textiles pour améliorer la solidité des couleurs et la luminosité des colorants.
- Galvanoplastie : utilisée en galvanoplastie pour déposer une couche de zinc sur des surfaces métalliques à des fins de protection contre la corrosion et à des fins décoratives.
- Ignifuge : Utilisé comme ignifuge dans les plastiques, le caoutchouc et d’autres matériaux pour réduire le risque d’incendie.
- Autres utilisations : Utilisé dans la production de pigments, de papier, de savons et de détergents.
Des questions:
Q : Qu’observeriez-vous lorsque du zinc est ajouté à une solution de sulfate de fer ?
R : Lorsque du zinc est ajouté à une solution de sulfate de fer, une réaction de déplacement se produit. Le zinc le plus réactif déplace le fer le moins réactif de la solution de sulfate, formant du sulfate de zinc et du fer métallique. La réaction peut être observée comme la formation d’un solide brun rougeâtre et la libération d’hydrogène gazeux.
Q : Que se passe-t-il lorsqu’un morceau de zinc est ajouté à une solution de sulfate de cuivre ?
R : Lorsqu’un morceau de zinc métallique est ajouté à une solution de sulfate de cuivre, une réaction de déplacement se produit. Le zinc est plus réactif que le cuivre, il déplace donc le cuivre de la solution de sulfate, formant du sulfate de zinc et un solide brun rougeâtre de cuivre métallique. La réaction peut être observée lorsque la solution devient bleue lorsque des ions de cuivre sont libérés dans la solution et la formation d’un dépôt de cuivre solide à la surface du zinc métallique.
Q : Le sulfate de zinc est-il un sel ?
R : Oui, le sulfate de zinc est un sel composé d’ions zinc (Zn2+) et d’ions sulfate (SO42-). Il s’agit d’un composé cristallin blanc de formule ZnSO4 et est couramment utilisé dans diverses applications telles que les engrais, l’alimentation animale et les médicaments.
Q : Où acheter de la poudre de sulfate de zinc ?
R : La poudre de sulfate de zinc peut être achetée auprès de fournisseurs de produits chimiques, de détaillants en ligne et de magasins de fournitures agricoles. Il est important de s’assurer que le produit est de haute qualité et adapté à l’usage prévu.
Q : Le sulfate de zinc est-il soluble ?
R : Oui, le sulfate de zinc est soluble dans l’eau et le glycérol. La solubilité du sulfate de zinc varie avec la température, avec une solubilité plus élevée à des températures plus élevées. La solubilité peut également être affectée par la présence d’autres ions dans la solution.
Q : À quoi sert le sulfate de zinc ?
R : Le sulfate de zinc a diverses applications, notamment son utilisation comme engrais, complément alimentaire pour animaux, agent de traitement de l’eau, médicament et dans la production de pigments, de papier et de textiles. Il est également utilisé dans la galvanoplastie, dans les produits ignifuges et comme complément alimentaire pour traiter la carence en zinc et favoriser la santé globale.
