Le sulfate de sodium est un composé cristallin blanc de formule Na2SO4. Il est utilisé dans les industries des détergents, de la fabrication du papier et de la verrerie comme agent de remplissage, agent de séchage et antimousse.
| Nom UICPA | Sulfate disodique |
| Formule moléculaire | Na2SO4 |
| Numero CAS | 7757-82-6 |
| Synonymes | Sulfate disodique, sulfate de sodium anhydre, sulfate de sodium |
| InChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Masse molaire
Le sulfate de sodium a une masse molaire de 142,04 g/mol. C’est un composé ionique composé de deux cations sodium (Na+) et d’un anion sulfate (SO42-). La masse molaire est calculée en additionnant les masses atomiques de tous les atomes d’une molécule de sulfate de sodium. Dans ce cas, nous avons deux atomes de sodium d’une masse de 22,99 g/mol chacun, un atome de soufre d’une masse de 32,06 g/mol et quatre atomes d’oxygène d’une masse de 15,99 g/mol chacun. Les additionner nous donne la masse molaire du sulfate de sodium.
Point d’ébullition du sulfate de sodium
Le sulfate de sodium a un point d’ébullition élevé de 1 429 °C (2 604 °F). Cela est dû à la nature ionique du composé, qui crée de fortes forces d’attraction électrostatiques entre les ions sodium chargés positivement et les ions sulfate chargés négativement. Pour vaincre ces forces, il faut une grande quantité d’énergie, c’est pourquoi le point d’ébullition du sulfate de sodium est si élevé.
Point de fusion du sulfate de sodium
Le point de fusion du sulfate de sodium varie en fonction de sa teneur en eau. Le sulfate de sodium anhydre (sans eau) a un point de fusion de 884 °C (1 623 °F). Cependant, le sulfate de sodium décahydraté (avec dix molécules d’eau) fond à une température inférieure de 32,4 °C (90,3 °F). La présence de molécules d’eau dans la structure cristalline du sulfate de sodium décahydraté affaiblit les liaisons ioniques entre les ions sodium et sulfate, ce qui réduit le point de fusion.
Densité du sulfate de sodium g/ml
La densité du sulfate de sodium varie selon sa forme. Le sulfate de sodium anhydre a une densité de 2,664 g/cm3, tandis que le sulfate de sodium décahydraté a une densité de 1,464 g/cm3. La différence de densité est due à la présence de molécules d’eau dans la structure cristalline du décahydrate, ce qui augmente son volume et diminue sa densité.
Sulfate De Sodium Poids moléculaire
Le poids moléculaire du sulfate de sodium est de 142,04 g/mol. Il s’agit de la masse d’une molécule de sulfate de sodium, composée de deux ions sodium et d’un ion sulfate.
Structure du sulfate de sodium
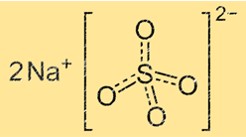
Le sulfate de sodium a une structure cristalline constituée d’unités répétitives d’ions sodium et sulfate. L’ion sulfate est un tétraèdre avec quatre atomes d’oxygène aux coins et un atome de soufre au centre. L’ion sodium est une petite sphère située entre les ions sulfate. La structure cristalline du sulfate de sodium peut varier en fonction de sa teneur en eau. Le sulfate de sodium anhydre a une structure cristalline différente de celle du sulfate de sodium décahydraté.
Formule de sulfate de sodium
La formule chimique du sulfate de sodium est Na2SO4. Cela signifie que chaque molécule de sulfate de sodium contient deux ions sodium (Na+) et un ion sulfate (SO42-). La formule représente le rapport de nombres entiers le plus simple d’atomes dans une molécule du composé.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,664 g/cm3 (anhydre), 1,464 g/cm3 (décahydraté) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 142,04 g/mole |
| Densité | 2,664 g/cm3 (anhydre), 1,464 g/cm3 (décahydraté) |
| Point de fusion | 884 °C (anhydre), 32,4 °C (décahydraté) |
| Point d’ébullition | 1 429 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 44,1 g/100 mL (anhydre), 47,6 g/100 mL (décahydraté) |
| Solubilité | Soluble dans l’eau, insoluble dans l’éthanol |
| Pression de vapeur | 0,01 mmHg à 20 °C |
| Densité de vapeur | N’est pas applicable |
| pKa | 1er : 2,01, 2ème : 7,20, 3ème : 9,41 |
| pH | 9-11 (solution à 10 %) |
Sécurité et dangers du sulfate de sodium
Le sulfate de sodium est généralement considéré comme sûr à utiliser, mais peut provoquer une irritation ou des dommages dans certaines circonstances. Il peut irriter la peau, les yeux et le système respiratoire par contact ou par inhalation. L’ingestion de grandes quantités peut provoquer des nausées, des vomissements et de la diarrhée. Il peut également être nocif pour la vie aquatique s’il est rejeté dans les cours d’eau. Le sulfate de sodium n’est pas considéré comme une matière inflammable ou explosive. Cependant, lorsqu’il est chauffé ou exposé à des températures élevées, il peut dégager des fumées toxiques. Il est important de suivre les procédures de manipulation appropriées, de porter un équipement de protection et de conserver le sulfate de sodium dans un endroit sûr et sécurisé.
| Symboles de danger | Aucun |
| Description de la sécurité | S24/25 : Éviter le contact avec la peau et les yeux. S36/37 : Porter des vêtements et des gants de protection appropriés. |
| Numéros d’identification de l’ONU | ONU 2118 |
| Code SH | 2833.11.00 |
| Classe de danger | Non dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) : 5 900 mg/kg |
Méthodes de synthèse du sulfate de sodium
Il existe différentes méthodes pour synthétiser le sulfate de sodium, notamment la réaction du chlorure de sodium avec l’acide sulfurique ou la réaction de l’hydroxyde de sodium avec l’acide sulfurique.
Pour produire du sulfate de sodium, la réaction du chlorure de sodium et de l’acide sulfurique génère du sulfate de sodium et du chlorure d’hydrogène gazeux. Le processus minimise les fumées nocives en effectuant la réaction exothermique dans des conditions contrôlées. Par la suite, la solution subit une filtration avant évaporation pour produire des cristaux de sulfate de sodium.
La synthèse du sulfate de sodium implique également de combiner l’acide sulfurique et l’hydroxyde de sodium pour former du sulfate de sodium et de l’eau. La réaction est exothermique et nécessite une manipulation prudente pour éviter un débordement. Après avoir filtré le mélange, la solution résultante est soumise à une évaporation pour donner des cristaux de sulfate de sodium.
Une autre méthode implique la réaction du carbonate de sodium avec l’acide sulfurique, produisant du sulfate de sodium, de l’eau et du dioxyde de carbone. Cette méthode nécessite l’utilisation d’une sorbonne en raison du dégagement de fumées toxiques. La solution est ensuite filtrée et évaporée pour obtenir des cristaux de sulfate de sodium.
D’autres procédés industriels, tels que la production de rayonne, de détergents et de verre, produisent également du sulfate de sodium comme sous-produit. Ces procédés produisent du sulfate de sodium comme déchet, qui peut être purifié et réutilisé à d’autres fins.
Utilisations du sulfate de sodium
Le sulfate de sodium a un large éventail d’utilisations dans diverses industries, notamment :
- Détergents : Utilisé comme agent de remplissage dans les détergents en poudre, contribuant à augmenter le volume et à améliorer l’écoulement du produit.
- Verre : Utilisé comme fondant dans la fabrication du verre, contribuant à réduire le point de fusion et à améliorer la clarté du produit final.
- Textiles : Utilisés dans la production de fibres synthétiques, comme la rayonne, pour améliorer la résistance et la durabilité du matériau.
- Papier : Utilisé comme agent de pâte à papier dans la production de papier, aidant à décomposer les fibres du bois et à éliminer les impuretés.
- Aliments : Utilisé comme additif alimentaire, principalement comme épaississant et émulsifiant dans les aliments transformés.
- Produits pharmaceutiques : utilisés dans la production de certains médicaments, tels que les laxatifs, pour aider à traiter la constipation.
- Produits chimiques : utilisés dans la production de divers produits chimiques, notamment le sulfure de sodium, le silicate de sodium et le bicarbonate de sodium.
- Traitement de l’eau : Utilisé dans les usines de traitement de l’eau pour éliminer les ions calcium et magnésium de l’eau dure.
- Forage pétrolier : utilisé dans le forage pétrolier comme agent alourdissant, aidant à contrôler la densité du fluide de forage.
Des questions:
Q : Quelle est la formule du sulfate de sodium ?
R : La formule chimique du sulfate de sodium est Na2SO4.
Q : Qu’est-ce que le sulfate de sodium ?
R : Le sulfate de sodium est un solide cristallin blanc couramment utilisé dans diverses applications industrielles, notamment les détergents, le verre, les textiles, le papier et les aliments.
Q : Le sulfate de sodium est-il acide ou basique ?
R : Le sulfate de sodium n’est ni acide ni basique ; c’est un composé neutre.
Q : Quelle est la couleur du sulfate de sodium ? R : Le sulfate de sodium est un solide cristallin blanc et, par conséquent, il est incolore.
