Le sulfate de potassium (K2SO4) est un composé qui contient du potassium, du soufre et de l’oxygène. Il est couramment utilisé comme engrais pour fournir les nutriments essentiels aux plantes et améliorer la qualité du sol.
| Nom UICPA | Sulfate de potassium |
| Formule moléculaire | K2SO4 |
| Numero CAS | 7778-80-5 |
| Synonymes | Acide sulfurique, sel dipotassique ; Sulfate dipotassique ; Arcanite ; Acide sulfurique, sel de potassium (1:2) ; sulfate de potassium; sal polychrestum; arcane duplicatum |
| InChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriétés du sulfate de potassium
Formule de sulfate de potassium
La formule chimique du sulfate de potassium est K2SO4. Cela signifie que chaque molécule de sulfate de potassium contient deux atomes de potassium, un atome de soufre et quatre atomes d’oxygène. La formule du sulfate de potassium est utile pour déterminer la stœchiométrie des réactions impliquant le composé, ainsi que pour calculer la quantité de sulfate de potassium nécessaire pour une application spécifique.
Sulfate De Potassium Masse molaire
K2SO4 a une masse molaire d’environ 174,259 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chaque élément du composé, qui sont deux atomes de potassium, un atome de soufre et quatre atomes d’oxygène. La masse molaire est une valeur utile pour déterminer la quantité de K2SO4 nécessaire pour une application spécifique, telle que la production d’engrais ou les expériences en laboratoire.
Point d’ébullition du sulfate de potassium
Le point d’ébullition du K2SO4 est d’environ 1 690 °C (3 074 °F). C’est la température à laquelle le composé passe de l’état liquide à l’état gazeux. Le point d’ébullition élevé du K2SO4 le rend utile pour les applications nécessitant une stabilité à haute température, comme dans la production d’engrais et de produits chimiques industriels.
Sulfate de Potassium Point de fusion
Le point de fusion du K2SO4 est d’environ 1 069 °C (1 956 °F). C’est la température à laquelle le composé solide passe à l’état liquide. Le point de fusion relativement élevé du K2SO4 le rend utile pour les applications à haute température, comme dans la production de verre, de céramique et d’engrais.
Densité du sulfate de potassium g/mL
La densité du K2SO4 est d’environ 2,66 g/mL à température ambiante. Cela signifie qu’un millilitre de K2SO4 pèse 2,66 grammes. La densité du K2SO4 dépend de la température et de la pression et peut être utilisée pour calculer la masse ou le volume du composé nécessaire pour une application spécifique.
Sulfate De Potassium Poids moléculaire
Le poids moléculaire du K2SO4 est de 174,259 g/mol. Cette valeur est calculée en additionnant les poids atomiques de tous les éléments du composé. Le poids moléculaire est utile pour calculer la quantité de K2SO4 nécessaire à des applications spécifiques, comme dans les engrais ou les produits chimiques industriels.
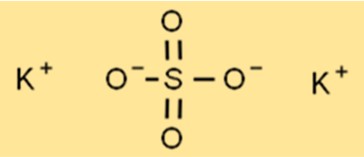
Structure du sulfate de potassium
La structure du K2SO4 est une structure de réseau cristallin, chaque ion potassium étant entouré de six ions oxygène de forme octaédrique. L’atome de soufre est situé au centre du réseau, chaque atome de soufre étant entouré de quatre ions oxygène en forme tétraédrique. Cette structure en treillis confère au K2SO4 ses propriétés caractéristiques, telles que ses points de fusion et d’ébullition élevés.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,66 à 20°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 174,259 g/mole |
| Densité | 2,66 g/cm³ à 20°C |
| Point de fusion | 1 069 °C (1 956 °F) |
| Point d’ébullition | 1 690 °C (3 074 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 111 g/L à 20°C |
| Solubilité | Soluble dans l’eau, insoluble dans l’éthanol |
| La pression de vapeur | 0,0 mmHg à 25°C |
| Densité de vapeur | N’est pas applicable |
| pKa | 1er : 2,17 ; 2ème : 7h20 ; 3ème : 11,8 |
| pH | 5,5-8,5 (solution à 1 %) |
Sécurité et dangers du sulfate de potassium
Le K2SO4 est généralement considéré comme sûr pour une utilisation en milieu industriel, agricole et en laboratoire. Cependant, le composé peut provoquer une irritation ou des dommages à la peau, aux yeux et au système respiratoire s’il est ingéré ou inhalé en grande quantité. De plus, le K2SO4 peut réagir avec certains produits chimiques, tels que les acides forts, pour produire des fumées ou des incendies dangereux. Il est important de manipuler le K2SO4 avec précaution, en utilisant un équipement de protection approprié et en suivant les consignes de sécurité. Le stockage du K2SO4 doit être effectué dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | S24/25 : Éviter le contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | ONU 6066 |
| Code SH | 3104.30.00 |
| Classe de danger | Non dangereux pour le transport |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse du sulfate de potassium
Plusieurs méthodes existent pour synthétiser le K2SO4.
Une méthode courante implique la réaction du chlorure de potassium avec l’acide sulfurique . La réaction produit du K2SO4 et du chlorure d’hydrogène comme sous-produit.
Une autre méthode implique la réaction de l’hydroxyde de potassium avec l’acide sulfurique . Cette réaction produit également du K2SO4 et de l’eau comme sous-produit.
Le K2SO4 peut également être obtenu à partir du minéral langbéinite, qui est un minéral naturel contenant du K2SO4, du sulfate de magnésium et du chlorure de sodium. En règle générale, les mineurs extraient le minéral et le traitent pour éliminer les impuretés et séparer le K2SO4.
Une autre méthode de production de K2SO4 implique la réaction du carbonate de potassium avec l’acide sulfurique . Cette réaction produit du K2SO4 et du dioxyde de carbone comme sous-produit.
Utilisations du sulfate de potassium
Le K2SO4 a un large éventail d’applications dans diverses industries. Voici quelques-unes des utilisations les plus courantes du K2SO4 :
- Engrais : Un engrais populaire en raison de sa teneur élevée en potassium. Utilisé dans la culture de fruits, légumes et autres cultures.
- Industrie du verre : Utilisé comme fondant dans la production de verre. Cela contribue à abaisser le point de fusion du verre et à améliorer sa durabilité.
- Industrie pharmaceutique : utilisé comme composant dans divers médicaments, notamment les laxatifs et les solutions de remplacement des électrolytes.
- Industrie alimentaire : Utilisé comme additif alimentaire pour réguler l’acidité et comme agent levant dans les produits de boulangerie.
- Applications industrielles : Utilisé dans plusieurs applications industrielles, notamment la production d’alun, de carbonate de potassium et d’autres produits chimiques.
- Aliments pour animaux : Utilisé comme complément alimentaire pour le bétail et la volaille afin de favoriser une croissance et un développement sains.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour contrôler le tartre et la corrosion dans les chaudières et autres équipements.
Des questions:
Q : Le sulfate de potassium est-il soluble ?
R : Oui, le K2SO4 est soluble dans l’eau. Il a une solubilité d’environ 111 g/L à température ambiante.
Q : Quel sera le produit solide lorsque le bromure de strontium et le sulfate de potassium réagiront ?
R : Lorsque le bromure de strontium et le K2SO4 réagissent, le produit solide formé est le sulfate de strontium (SrSO4) qui est un solide blanc insoluble.
Q : Qu’est-ce qui est produit d’autre lors de la réaction de remplacement du nitrate d’argent et du sulfate de potassium ?
R : Dans la réaction de remplacement du nitrate d’argent et du K2SO4, du sulfate d’argent (Ag2SO4) et du nitrate de potassium (KNO3) sont également produits.
Q : Le sulfate de potassium est-il un acide ou une base ?
R : K2SO4 n’est ni un acide ni une base, c’est un sel. Il est formé à partir de la réaction de neutralisation entre un acide (acide sulfurique) et une base (hydroxyde de potassium).
Q : Le k2so4 est-il soluble dans l’eau ?
R : Oui, le K2SO4 est soluble dans l’eau. Il est très soluble et sa solubilité augmente avec la température.
Q : Quel sel est produit lorsque le h2so4 réagit avec le naoh ? k2so3 na2so4 na2so3 k2so4 A : Lorsque H2SO4 réagit avec NaOH, le sel produit est Na2SO4 (sulfate de sodium) avec de l’eau.
Q : Combien de moles de k2so4 y a-t-il dans 15,0 g de k2so4 ?
R : Pour déterminer le nombre de moles de K2SO4 dans 15,0 g de K2SO4, nous devons diviser la masse donnée par la masse molaire de K2SO4 qui est de 174,259 g/mol. Ainsi, le nombre de moles de K2SO4 dans 15,0 g est de 0,086 mole.
Q : Quelle serait la formule du précipité qui se forme lorsque pb(no3)2 (aq) et k2so4 (aq) sont mélangés ?
R : Lorsque Pb(NO3)2 (aq) et K2SO4 (aq) sont mélangés, le précipité formé est du PbSO4 (sulfate de plomb), qui est un solide blanc insoluble. L’équation équilibrée de cette réaction est Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
