Le sulfate de nickel (NiSO4) est un composé composé d’atomes de nickel, de soufre et d’oxygène. Il est couramment utilisé dans la galvanoplastie, les catalyseurs et comme nutriment dans certains engrais.
| Nom UICPA | Sulfate de nickel(II) |
| Formule moléculaire | NiSO4 |
| Numero CAS | 7786-81-4 |
| Synonymes | Sulfate de nickel, sel de nickel de l’acide sulfurique, sulfate de nickel (II), nickel (2+); sulfate |
| InChI | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriétés du sulfate de nickel
Formule de sulfate de nickel
La formule chimique du sulfate de nickel est NiSO4. Il représente la combinaison d’un atome de nickel (Ni) et d’un groupe sulfate (SO4). La formule indique clairement la présence de nickel et de soufre, ainsi que d’oxygène dans le groupe sulfate.
Sulfate De Nickel Masse molaire
La masse molaire du sulfate de nickel (NiSO4) est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le nickel (Ni) a une masse atomique d’environ 58,69 grammes par mole, tandis que le soufre (S) a une masse atomique d’environ 32,07 grammes par mole et l’oxygène (O) a une masse atomique d’environ 16 grammes par mole. En additionnant ces valeurs, la masse molaire du sulfate de nickel est déterminée à environ 154,76 grammes par mole.
Point d’ébullition du sulfate de nickel
Le sulfate de nickel n’a pas de point d’ébullition spécifique car il se décompose lorsqu’il est chauffé. Cependant, il est important de noter que sa température de décomposition est influencée par des facteurs tels que la pression et la présence d’autres substances. Par conséquent, il est conseillé de manipuler le sulfate de nickel avec prudence lorsqu’il est exposé à des températures élevées.
Sulfate de nickel Point de fusion
Le point de fusion du sulfate de nickel est d’environ 100 degrés Celsius (212 degrés Fahrenheit). À cette température, la forme solide du sulfate de nickel passe à l’état liquide. Il convient de mentionner que les variations de pureté et de structure cristalline du sulfate de nickel peuvent légèrement affecter son point de fusion.
Densité du sulfate de nickel g/mL
La densité du sulfate de nickel fait référence à sa masse par unité de volume. La densité du sulfate de nickel est généralement d’environ 3,68 grammes par millilitre (g/mL). Il convient de noter que la densité peut varier en fonction de la température et de la pureté de l’échantillon.
Nickel Sulfate Poids moléculaire
Le poids moléculaire du sulfate de nickel (NiSO4) est la somme des poids atomiques de ses éléments constitutifs. Comme mentionné précédemment, le poids moléculaire du sulfate de nickel est d’environ 154,76 grammes par mole.
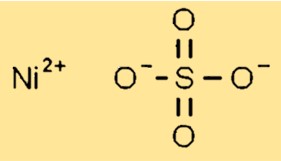
Structure du sulfate de nickel
Le sulfate de nickel possède une structure cristalline à l’état solide. Il forme des cristaux monocliniques avec chaque ion nickel (Ni2+) entouré de six atomes d’oxygène provenant de groupes sulfate. Les groupes sulfate sont disposés de manière à permettre un compactage efficace du réseau cristallin.
Solubilité du sulfate de nickel
Le sulfate de nickel présente une solubilité modérée dans l’eau. Il se dissout facilement dans l’eau, sa solubilité augmentant à mesure que la température augmente. La présence d’autres ions et substances peut influencer sa solubilité. De plus, le sulfate de nickel peut former des hydrates lorsqu’il est combiné avec des molécules d’eau, conduisant à la formation de divers hydrates de sulfate de nickel.
| Apparence | Cristaux bleu/vert |
| Gravité spécifique | 3,68 g/ml |
| Couleur | Bleu vert |
| Odeur | Inodore |
| Masse molaire | 154,76 g/mole |
| Densité | 3,68 g/ml |
| Point de fusion | 100 °C (212 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et les solvants organiques tels que l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | -1,1 (acide sulfurique) |
| pH | Acide (environ 4) |
Sécurité et dangers du sulfate de nickel
Le sulfate de nickel présente certains risques pour la sécurité qui doivent être pris en compte. Il est essentiel de le manipuler avec précaution pour éviter les risques potentiels. Le contact direct avec la peau doit être minimisé, car il peut provoquer une irritation ou une sensibilisation cutanée. L’ingestion ou l’inhalation de sulfate de nickel doit être évitée, car cela peut entraîner des effets néfastes sur la santé. Lorsque vous travaillez avec du sulfate de nickel, un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté pour éviter tout contact avec la substance. Le sulfate de nickel doit être stocké dans un endroit frais et sec, à l’écart des matières incompatibles. Une ventilation adéquate est nécessaire lorsque l’on travaille avec du sulfate de nickel pour minimiser la concentration de particules en suspension dans l’air.
| Symboles de danger | Aucun |
| Description de la sécurité | – Eviter le contact avec la peau – Eviter l’ingestion et l’inhalation – Porter un équipement de protection individuelle approprié |
| Identifiants des Nations Unies | N’est pas applicable |
| Code SH | 2833.25 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Peut provoquer une irritation ou une sensibilisation de la peau |
Méthodes de synthèse du sulfate de nickel
Il existe différentes méthodes de synthèse du sulfate de nickel.
Une approche courante implique la réaction entre le nickel métallique ou l’oxyde de nickel avec l’acide sulfurique . Dans cette méthode, l’acide sulfurique dissout le Ni métallique ou l’oxyde de nickel, entraînant la formation de sulfate de nickel. Vous pouvez effectuer la réaction dans des conditions contrôlées, telles que la température et l’agitation, pour garantir une conversion efficace.
Une autre méthode implique la réaction de l’acide sulfurique avec le carbonate de nickel. L’acide sulfurique dissout le carbonate de nickel, produisant du sulfate de nickel. Les chimistes utilisent généralement cette méthode lorsqu’ils disposent de carbonate de nickel facilement disponible, car il offre un matériau de départ pratique.
De plus, l’acide sulfurique peut dissoudre l’hydroxyde de nickel pour synthétiser du NiSO4. La dissolution de l’hydroxyde de nickel dans l’acide sulfurique conduit à la formation de NiSO4. Cette méthode convient lorsque l’on souhaite utiliser l’hydroxyde de nickel comme précurseur pour la synthèse du sulfate de nickel.
Il est important de noter que vous devez suivre les précautions de sécurité appropriées pendant le processus de synthèse. Cela comprend l’utilisation d’un équipement de protection et de procédures de manipulation appropriés. Effectuer les réactions dans un endroit bien ventilé pour minimiser le risque d’exposition à des vapeurs nocives. Un contrôle minutieux des paramètres de réaction, tels que la température et la concentration, est crucial pour garantir une conversion et un rendement optimaux en sulfate de nickel.
Utilisations du sulfate de nickel
Le sulfate de nickel a diverses applications dans différentes industries. Voici quelques-unes de ses utilisations courantes :
- Galvanoplastie : les processus de galvanoplastie utilisent largement du sulfate de nickel pour créer un revêtement durable et résistant à la corrosion sur les surfaces métalliques. Le sulfate de nickel améliore l’apparence, la dureté et la résistance des objets comme les bijoux, les pièces automobiles et les ustensiles de cuisine.
- Catalyseur : Le sulfate de nickel agit comme catalyseur dans de nombreuses réactions chimiques, notamment les processus d’hydrogénation et d’oxydation. Les industries utilisent des catalyseurs au sulfate de nickel dans la production de produits pharmaceutiques, pétrochimiques et de chimie fine.
- Piles : Les piles rechargeables, en particulier les piles Ni-Cd et Ni-MH, contiennent du sulfate de nickel comme composant essentiel. Le sulfate de nickel facilite les réactions des électrodes et assure un stockage et une libération efficaces de l’énergie électrique.
- Engrais : Certains engrais utilisent du Ni soluble provenant du sulfate de nickel pour fournir aux plantes des nutriments essentiels. Le nickel joue un rôle crucial dans divers processus métaboliques des plantes, contribuant à leur croissance et à leur développement.
- Textiles : L’industrie textile utilise du sulfate de nickel dans les processus de teinture et d’impression pour améliorer la solidité des couleurs et l’absorption des teintures des tissus. Le sulfate de nickel garantit des résultats de couleur éclatants et durables.
- Produits pharmaceutiques : le sulfate de nickel trouve des applications dans les préparations pharmaceutiques, principalement pour produire des médicaments contenant du Ni comme ingrédient actif ou pour formuler des complexes de Ni spécifiques utilisés dans la recherche médicale.
- Recherche et développement : les laboratoires utilisent le sulfate de nickel à diverses fins de recherche et développement, notamment la synthèse chimique, les études électrochimiques et les recherches en science des matériaux.
Des questions:
Q : Quelle est la formule du sulfate de nickel (II) ?
R : La formule du sulfate de nickel(II) est NiSO4.
Q : Du chrome métallique est ajouté à une solution de sulfate de nickel (II). Quelle est la réaction chimique équilibrée ?
R : La réaction chimique équilibrée est la suivante : Cr + NiSO4 -> CrSO4 + Ni.
Q : Comment fabriquer du sulfate de nickel-ammonium ?
R : Le sulfate de nickel-ammonium peut être préparé en dissolvant le sulfate de nickel et le sulfate d’ammonium dans l’eau, suivi d’une cristallisation.
Q : Le sulfate de nickel est-il soluble dans l’eau ?
R : Oui, le sulfate de nickel est soluble dans l’eau.
Q : Qui extrait le sulfate de nickel ?
R : Le sulfate de nickel n’est pas extrait directement. Des minerais de nickel sont extraits et du sulfate de nickel peut être produit à partir de ceux-ci.
Q : Quel est le nom du composé NiSO4 ?
R : Le composé NiSO4 est appelé sulfate de nickel.
Q : Combien de grammes de NiSO4 y a-t-il dans 100 g d’hydrate ? Combien de taupes ?
R : La quantité de NiSO4 dans 100 g d’hydrate dépend du composé hydraté spécifique et de sa masse molaire.
Q : Le NiSO4 est-il soluble dans l’eau ?
R : Oui, le NiSO4 est soluble dans l’eau.
Q : Combien de grammes de NiSO4 sont obtenus si le rendement est de 76,9 % ?
R : Les grammes de NiSO4 obtenus dépendent de la quantité initiale et des conditions de la réaction.
Q : Le NiSO4 est-il dangereux ?
R : Le NiSO4 peut être dangereux s’il n’est pas manipulé correctement. Il est important de suivre les consignes de sécurité lorsque vous travaillez avec.
Q : Quel est le nom du composé covalent NiSO4 ?
R : NiSO4 n’est pas un composé covalent. C’est un composé ionique appelé sulfate de nickel.
Q : Le NiSO4 est-il un sel ?
R : Oui, le NiSO4 est considéré comme un sel en raison de sa nature ionique et de sa formation à partir de la réaction entre un acide (acide sulfurique) et une base (hydroxyde de nickel).
Q : Quelle est la charge du NiSO4 ?
R : Dans NiSO4, l’ion nickel (Ni2+) porte une charge positive de 2+, tandis que l’ion sulfate (SO4 2-) porte une charge négative de 2-.
