Le sulfate de magnésium (sulfate) ou MgSo4 est un composé chimique composé de magnésium, de soufre et d’oxygène. Il est couramment utilisé en médecine comme laxatif, anticonvulsivant et pour traiter les carences en magnésium.
| Nom UICPA | Sulfate de magnésium |
| Formule moléculaire | MgSO4 |
| Numero CAS | 7487-88-9 |
| Synonymes | Sel d’Epsom; Sel anglais; Sel amer; Sel de bain; Sel d’Epsom; Sal anglicum; Sulfate de magnésium heptahydraté |
| InChI | InChI=1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
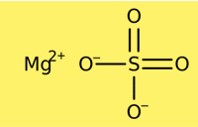
Formule de sulfate de magnésium
La formule chimique du sulfate de magnésium est MgSO4. Cette formule indique que le sulfate de magnésium est composé d’un cation magnésium (Mg2+) et d’un anion sulfate (SO42-). La formule du sulfate de magnésium est importante dans les calculs chimiques car elle aide à déterminer la quantité d’une substance nécessaire dans une réaction chimique.
MgSO4 masse molaire
La masse molaire du sulfate de magnésium est de 120,366 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de magnésium (24,305 g/mol), d’un atome de soufre (32,066 g/mol) et de quatre atomes d’oxygène (15,999 g/mol chacun). La masse molaire est un paramètre important dans les calculs chimiques car elle permet de déterminer la quantité d’une substance nécessaire dans une réaction chimique.
Point d’ébullition du sulfate de magnésium
Le point d’ébullition du sulfate de magnésium dépend de l’état du composé. Le sulfate de magnésium existe sous deux formes anhydre et heptahydraté. La forme anhydre a un point d’ébullition plus élevé de 1 124 °C (2 055 °F), tandis que la forme heptahydratée a un point d’ébullition inférieur de 150 °C (302 °F). Le point d’ébullition du sulfate de magnésium peut être affecté par des facteurs tels que la pression et les impuretés.
Point de fusion du sulfate de magnésium
Le point de fusion du sulfate de magnésium dépend également de l’état du composé. La forme anhydre a un point de fusion plus élevé de 1 124 °C (2 055 °F), tandis que la forme heptahydratée a un point de fusion inférieur de 150 °C (302 °F). Le point de fusion du sulfate de magnésium peut également être affecté par des facteurs tels que la pression et les impuretés.
Densité du sulfate de magnésium g/ml
La densité du sulfate de magnésium varie en fonction de l’état du composé. La forme anhydre a une densité de 2,66 g/cm³, tandis que la forme heptahydratée a une densité de 1,68 g/cm³. La densité est une propriété physique d’une substance qui indique la quantité de masse par unité de volume. La densité du sulfate de magnésium peut être utilisée pour calculer le volume d’une substance nécessaire à une réaction chimique.
Poids moléculaire du sulfate de magnésium
Le poids moléculaire du sulfate de magnésium est de 120,366 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de magnésium (24,305 g/mol), d’un atome de soufre (32,066 g/mol) et de quatre atomes d’oxygène (15,999 g/mol chacun). Le poids moléculaire est un paramètre important dans les calculs chimiques car il permet de déterminer la quantité d’une substance nécessaire dans une réaction chimique.
Structure du sulfate de magnésium
Le sulfate de magnésium a une structure cristalline. La forme anhydre a une structure cristalline rhomboédrique, tandis que la forme heptahydratée a une structure cristalline monoclinique. La structure cristalline du sulfate de magnésium est composée de cations magnésium et d’anions sulfate. La forme anhydre contient un cation magnésium et un anion sulfate par cellule, tandis que la forme heptahydratée contient un cation magnésium et deux anions sulfate par cellule.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,66 (anhydre) 1,68 (heptahydraté) |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 120,366 g/mole |
| Densité | 2,66 g/cm³ (anhydre) 1,68 g/cm³ (heptahydraté) |
| Point de fusion | 1 124 °C (anhydre) 150 °C (heptahydraté) |
| Point d’ébullition | 1 124 °C (anhydre) 150 °C (heptahydraté) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 71,6 g/100 ml (20 °C) |
| Solubilité | Soluble dans l’eau et l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | 9,99 |
| pH | 6,0 – 8,0 (solution à 5 %) |
Sécurité et dangers du sulfate de magnésium
Le sulfate de magnésium est généralement considéré comme sûr lorsqu’il est manipulé correctement. Cependant, il peut présenter certains dangers s’il n’est pas manipulé avec précaution. L’exposition à la poussière de sulfate de magnésium peut irriter les yeux, la peau et le système respiratoire. L’ingestion ou l’injection de grandes quantités de sulfate de magnésium peut provoquer de la diarrhée, des crampes d’estomac et une déshydratation. Il est important de porter des équipements de protection, tels que des gants et des lunettes, lors de la manipulation du sulfate de magnésium afin d’éviter toute irritation de la peau et des yeux. En cas d’ingestion ou d’exposition, consulter immédiatement un médecin. Le sulfate de magnésium doit être stocké dans un endroit frais et sec, à l’écart des sources de chaleur et des matières incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | S22 – Ne pas respirer les poussières ; S24/25 – Éviter tout contact avec la peau et les yeux ; S36 – Porter des vêtements de protection adaptés ; S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin ; S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette) |
| Identifiants ONU | UN3077 |
| Code SH | 28332100 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) > 3 000 mg/kg ; DL50 (cutanée, rat) > 2 000 mg/kg |
Méthodes de synthèse du sulfate de magnésium
Différentes méthodes existent pour synthétiser le sulfate de magnésium (MgSO4).
Une méthode courante consiste à faire réagir de l’oxyde de magnésium ou de l’hydroxyde de magnésium avec de l’acide sulfurique. Le processus consiste à ajouter de l’oxyde ou de l’hydroxyde de magnésium à l’acide sulfurique tout en remuant jusqu’à ce que le mélange se dissolve complètement. Recueillir les cristaux de magnésium MgSO4 en évaporant la solution pour éliminer l’excès d’eau.
Une autre approche consiste à ajouter lentement du carbonate de magnésium à l’acide sulfurique tout en remuant jusqu’à dissolution complète. Pour obtenir des cristaux de magnésium MgSO4, filtrez la solution obtenue pour éliminer toutes les impuretés et évaporez-la.
Faire réagir le magnésium avec l’acide sulfurique et chauffer le mélange jusqu’à ce que la réaction soit terminée, puis filtrer et évaporer la solution obtenue pour obtenir les cristaux de magnésium MgSO4.
Vous pouvez également obtenir du magnésium MgSO4 en faisant réagir du chlorure de magnésium avec du sodium MgSO4. Le processus consiste à ajouter du chlorure de magnésium à une solution de sodium MgSO4, à agiter le mélange obtenu et à le chauffer jusqu’à ce que des cristaux de magnésium MgSO4 se forment.
Utilisations du sulfate de magnésium
Le sulfate de magnésium (MgSO4) a de nombreuses applications dans divers domaines. Certaines de ses utilisations incluent :
- Utilisations médicales : Utilisé comme traitement de l’éclampsie et de la pré-éclampsie pendant la grossesse, ainsi que pour prévenir les convulsions chez les patientes souffrant d’asthme sévère ou d’hypomagnésémie. Il sert de cathartique et de laxatif.
- Agriculture : Utilisé comme engrais en raison de sa teneur élevée en magnésium et en soufre. Les agriculteurs l’utilisent pour corriger les carences en magnésium des sols.
- Industrie alimentaire et des boissons : utilisé comme sel de brassage dans la production de bière pour ajuster la chimie de l’eau et améliorer la saveur. L’industrie agroalimentaire l’utilise comme coagulant dans la production de tofu.
- Applications industrielles : Utilisé comme agent de séchage et dessicant, ainsi que comme ignifuge. Diverses industries l’utilisent dans la fabrication de textiles, de papier et de produits chimiques.
- Soins personnels : les gens utilisent le sulfate de magnésium dans les sels de bain et les bains de pieds pour ses bienfaits revendiqués sur la santé, notamment la réduction des douleurs et des raideurs musculaires.
- Autres utilisations : Utilisé dans la production de pigments, d’explosifs et dans la purification des métaux.
Des questions:
Q : Qu’est-ce qu’une base utilisée dans le dentifrice ?
R : La base la plus couramment utilisée dans les dentifrices est généralement le carbonate de calcium ou le bicarbonate de sodium. Ces bases aident à frotter les dents et à éliminer la plaque dentaire.
Q : À quoi sert le sulfate de magnésium ?
R : Le sulfate de magnésium a diverses utilisations, notamment comme traitement de l’éclampsie et de la pré-éclampsie pendant la grossesse, comme cathartique et laxatif, comme engrais, comme sel de brassage, comme ignifuge et comme agent desséchant. Il est également utilisé dans la fabrication de textiles, de papier et de produits chimiques.
Q : Le sulfate de magnésium est-il soluble ?
R : Le sulfate de magnésium est soluble dans l’eau et l’alcool.
Q : Le sulfate de magnésium est-il soluble dans l’eau ?
R : Oui, le sulfate de magnésium est hautement soluble dans l’eau, avec une solubilité d’environ 25,5 g/100 ml à température ambiante.
Q : À quoi sert le sulfate de magnésium ?
R : Le sulfate de magnésium a diverses utilisations et avantages en fonction de l’application spécifique. Certaines de ses utilisations comprennent comme traitement médical, comme engrais, comme sel de brassage, comme ignifuge et comme agent de séchage. En médecine, le sulfate de magnésium peut être utilisé pour prévenir les convulsions, traiter la constipation et réduire les douleurs et raideurs musculaires.
