Le sulfate de cuivre est un solide cristallin bleu de formule CuSO4. Il est couramment utilisé en agriculture, comme fongicide et dans la production de colorants et de pigments.
| Nom UICPA | Sulfate de cuivre(II) |
| Formule moléculaire | CuSO4 |
| Numero CAS | 7758-98-7 |
| Synonymes | Vitriol bleu, sulfate de cuivre, sulfate de cuivre, sel de cuivre (2+) d’acide sulfurique, sulfate de cuivre (II), vitriol de cuivre, pierre bleue |
| InChI | InChI=1S/Cu.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Masse molaire de Sulfate De Cuivre
Le sulfate de cuivre a une masse molaire de 159,609 g/mol pour la forme anhydre (CuSO4) et de 249,685 g/mol pour la forme pentahydratée (CuSO4·5H2O). La masse molaire est la somme des masses atomiques de tous les atomes d’une molécule. La masse molaire du sulfate de cuivre est calculée en additionnant la masse atomique d’un atome de cuivre (Cu), d’un atome de soufre (S) et de quatre atomes d’oxygène (O) sous forme anhydre, ou en ajoutant la masse molaire de la forme anhydre avec le masse molaire de cinq molécules d’eau (H2O) sous forme pentahydratée.
Point d’ébullition du sulfate de cuivre
Le sulfate de cuivre n’a pas de point d’ébullition spécifique, car il se décompose avant d’atteindre son point d’ébullition. Cependant, la forme pentahydratée du sulfate de cuivre perdra des molécules d’eau lorsqu’elle est chauffée, ce qui donnera du sulfate de cuivre anhydre, qui se décompose à environ 650 °C. La décomposition du sulfate de cuivre est un processus endothermique, c’est-à-dire qu’il absorbe de la chaleur.
Point de fusion du sulfate de cuivre
Le sulfate de cuivre a un point de fusion de 110 °C pour la forme pentahydratée et de 650 °C pour la forme anhydre. Le point de fusion est la température à laquelle une substance solide passe à l’état liquide. La forme pentahydratée du sulfate de cuivre fond à une température plus basse que la forme anhydre en raison de la présence de molécules d’eau, qui peuvent perturber les liaisons ioniques entre les atomes de cuivre, de soufre et d’oxygène.
Densité du sulfate de cuivre g/ml
Le sulfate de cuivre a une densité de 3,6 g/mL pour la forme anhydre et de 2,284 g/mL pour la forme pentahydratée. La densité est la mesure de la masse par unité de volume. La densité du sulfate de cuivre est affectée par le nombre de molécules d’eau dans sa structure, car la forme pentahydratée contient plus de molécules d’eau par unité de volume que la forme anhydre.
Poids moléculaire du sulfate de cuivre
Le sulfate de cuivre a un poids moléculaire de 159,609 g/mol pour la forme anhydre et de 249,685 g/mol pour la forme pentahydratée. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire du sulfate de cuivre est utilisé dans les réactions chimiques et les calculs de stœchiométrie pour déterminer la quantité de sulfate de cuivre nécessaire ou produite.
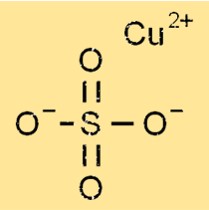
Structure du sulfate de cuivre
Le sulfate de cuivre a une structure octaédrique sous forme anhydre et pentahydratée, où un atome de cuivre est entouré de quatre atomes d’oxygène et de deux atomes de soufre. Sous forme pentahydratée, cinq molécules d’eau sont attachées à la structure octaédrique, formant un réseau cristallin hydraté. Les liaisons ioniques entre les molécules de cuivre, de soufre, d’oxygène et d’eau aboutissent à la structure cristalline du sulfate de cuivre.
Formule de sulfate de cuivre
La formule du sulfate cuivrique est CuSO4, ce qui indique qu’il est composé d’un atome de cuivre (Cu), d’un atome de soufre (S) et de quatre atomes d’oxygène (O). Il est également communément connu sous le nom de sulfate de cuivre (II) ou de Vitriol bleu. La formule indique le nombre d’atomes de chaque élément présent dans une molécule.
| Apparence | Solide cristallin bleu |
| Gravité spécifique | 3,6 (anhydre) ; |
| Couleur | Bleu |
| Odeur | Inodore |
| Masse molaire | 159,609 g/mol (anhydre) ; |
| Densité | 3,6 g/mL (anhydre) ; |
| Point de fusion | 110 °C (pentahydraté) ; |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 31,6 g/100 ml (20 °C) |
| Solubilité | Soluble dans le méthanol, le glycérol, légèrement soluble dans l’éthanol, insoluble dans l’éther |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 1,99 |
| pH | 3,5 – 4,5 |
Sécurité et dangers du sulfate de cuivre
Le sulfate de cuivre peut présenter des risques pour la santé s’il n’est pas manipulé correctement. Il est nocif en cas d’ingestion et peut provoquer des irritations ou des brûlures s’il entre en contact avec la peau ou les yeux. L’inhalation de ses poussières ou de ses vapeurs peut entraîner une irritation ou des dommages respiratoires. C’est également un danger potentiel pour l’environnement et peut être toxique pour la vie aquatique. Des précautions doivent être prises lors de la manipulation du sulfate de cuivre, comme le port de vêtements de protection, de gants et de lunettes. En cas d’ingestion, contacter un centre antipoison ou consulter immédiatement un médecin. En cas de contact avec la peau ou les yeux, rincer à l’eau pendant plusieurs minutes et consulter un médecin.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Porter des gants de protection et une protection pour les yeux/le visage. En cas d’ingestion, consulter un médecin. |
| Identifiants ONU | UN3077 (pour anhydre); UN1512 (pour pentahydraté) |
| Code SH | 2833.25.00 |
| Classe de danger | 9 (Marchandises dangereuses diverses) |
| Groupe d’emballage | III |
| Toxicité | Peut être nocif en cas d’ingestion, provoque une irritation de la peau et des yeux et peut provoquer une irritation des voies respiratoires. |
Méthodes de synthèse du sulfate de cuivre
Pour synthétiser le sulfate de cuivre, on peut utiliser diverses méthodes, telles que la réaction du cuivre avec de l’acide sulfurique ou de l’oxyde de cuivre ou de l’hydroxyde de cuivre avec de l’acide sulfurique.
Pour synthétiser le sulfate de cuivre en utilisant la première méthode, on ajoute du cuivre dans un récipient de réaction contenant de l’acide sulfurique et on applique de la chaleur pour lancer la réaction. Le cuivre réagit avec l’acide sulfurique, entraînant la production de sulfate de cuivre et d’eau. Après cela, on refroidit le mélange obtenu et on le filtre pour séparer les cristaux de sulfate de cuivre de la solution restante.
Pour synthétiser le sulfate de cuivre, on peut faire réagir l’oxyde de cuivre ou l’hydroxyde de cuivre avec de l’acide sulfurique dans un récipient de réaction. Après la réaction, le mélange est refroidi et les cristaux de sulfate de cuivre sont filtrés de la solution restante.
Une autre méthode implique la réaction du cuivre avec du dioxyde de soufre et de l’oxygène dans un récipient de réaction. La réaction produit du sulfate de cuivre et de l’eau. Le mélange résultant est refroidi et filtré pour obtenir les cristaux de sulfate de cuivre.
Pour produire du sulfate de cuivre, on peut utiliser la méthode d’électrolyse. Dans ce processus, une solution aqueuse de sulfate de cuivre subit une électrolyse, ce qui entraîne un dépôt de sulfate de cuivre sur l’anode. Ensuite, les cristaux de sulfate de cuivre sont séparés de la solution et séchés.
Utilisations du sulfate de cuivre
Certaines des utilisations courantes du sulfate de cuivre comprennent :
- Utilisé comme engrais pour apporter au sol du Cuivre, indispensable à la croissance des plantes. Utilisé comme pesticide pour lutter contre les maladies fongiques dans les cultures.
- Ajouté à l’alimentation animale comme source de cuivre, nécessaire à la croissance et au développement des animaux.
Industrie
- Utilisé en galvanoplastie pour déposer du cuivre à la surface d’autres métaux, ce qui améliore leur résistance à la corrosion.
- Utilisé dans le traitement de l’eau comme algicide et floculant pour éliminer les algues et autres impuretés de l’eau.
- Utilisé en chimie analytique comme réactif pour la détermination des sucres réducteurs et des protéines.
- Utilisé dans l’industrie textile comme mordant pour fixer les teintures sur les tissus et leur donner une couleur plus éclatante.
- Utilisé dans l’industrie pharmaceutique comme source de cuivre pour les suppléments nutritionnels et les médicaments.
- Également utilisé dans la production de pigments, d’encres et de peintures, ainsi que dans la fabrication de batteries, de catalyseurs et de produits de préservation du bois.
Des questions: Q : Le sulfate de cuivre est-il soluble dans l’eau ?
R : Oui, le sulfate de cuivre est hautement soluble dans l’eau. À température ambiante, il peut se dissoudre dans l’eau jusqu’à un maximum de 203 grammes pour 100 millilitres d’eau.
Q : Où acheter du sulfate de cuivre près de chez moi ?
R : Le sulfate de cuivre est facilement disponible à l’achat dans la plupart des quincailleries, des jardineries et des détaillants en ligne. Vous pouvez également vérifier auprès de votre magasin de fournitures agricoles ou magasin d’aliments pour animaux local, car le sulfate de cuivre est couramment utilisé dans l’agriculture et l’alimentation animale.
Q : Quelle quantité de sulfate de cuivre par gallon d’eau ?
R : La quantité de sulfate de cuivre nécessaire par gallon d’eau dépend de l’application spécifique. Par exemple, en agriculture, le taux d’application recommandé se situe généralement entre 1 et 10 livres par acre. Dans le traitement de l’eau, la dose recommandée se situe généralement entre 0,2 et 1,0 milligrammes par litre d’eau. Il est important de suivre attentivement les instructions figurant sur l’étiquette du produit sulfate de cuivre pour garantir une utilisation appropriée.
Q : Quelle est la formule du sulfate de cuivre (ii) ?
R : La formule du sulfate de cuivre (II) est CuSO4.
