Le sulfate de calcium (CaSO4) est une poudre blanche présente naturellement ou produite industriellement. Il est utilisé dans la construction, l’alimentation et la médecine en raison de ses propriétés de liant, de charge et de nutriment.
| Nom UICPA | Sulfate de calcium |
| Formule moléculaire | CaSO4 |
| Numero CAS | 7778-18-9 |
| Synonymes | Gypse, gypse anhydre, anhydrite, dihydraté, sel de calcium, sélénite |
| InChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriétés du sulfate de calcium
Formule de sulfate de calcium
La formule chimique du sulfate de calcium est CaSO4. Cela signifie que chaque molécule de sulfate de calcium contient un atome de calcium, un atome de soufre et quatre atomes d’oxygène. La formule est utilisée pour représenter la composition du sulfate de calcium dans des équations chimiques et pour calculer la quantité de réactifs nécessaires dans les réactions chimiques.
Sulfate De Calcium Masse molaire
La masse molaire du CaSO4 est d’environ 136,14 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de calcium, d’un atome de soufre et de quatre atomes d’oxygène dans le composé. La masse molaire est utilisée pour déterminer la quantité de CaSO4 nécessaire dans les réactions chimiques et pour calculer sa concentration dans les solutions.
Point d’ébullition du sulfate de calcium
Le CaSO4 n’a pas de point d’ébullition défini car il subit une décomposition thermique avant d’atteindre son point d’ébullition. Cependant, il peut être chauffé à des températures supérieures à 200°C sans subir de décomposition. À des températures plus élevées, le CaSO4 subit une décomposition endothermique pour former de l’oxyde de calcium et du trioxyde de soufre.
Sulfate de Calcium Point de fusion
Le point de fusion du CaSO4 dépend de son état d’hydratation. La forme anhydre de CaSO4 a un point de fusion d’environ 1 460 °C, tandis que la forme dihydratée a un point de fusion inférieur d’environ 128 °C. Les formes hémihydratées et trihydratées ont des points de fusion intermédiaires.
Densité du sulfate de calcium g/mL
La densité du CaSO4 dépend de sa forme et de son état d’hydratation. La forme anhydre de CaSO4 a une densité d’environ 2,96 g/mL, tandis que la forme dihydratée a une densité d’environ 2,32 g/mL. Les formes hémihydratées et trihydratées ont des densités intermédiaires.
Sulfate De Calcium Poids moléculaire
Le poids moléculaire du CaSO4 est d’environ 136,14 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de calcium, d’un atome de soufre et de quatre atomes d’oxygène dans le composé. Le poids moléculaire est utilisé pour calculer la quantité de CaSO4 nécessaire dans les réactions chimiques et pour déterminer sa concentration dans les solutions.
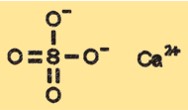
Structure du sulfate de calcium
Le CaSO4 a une structure cristalline qui peut varier en fonction de son état d’hydratation. La forme anhydre de CaSO4 a une structure cristalline classée comme orthorhombique, tandis que la forme dihydratée a une structure cristalline monoclinique. Les formes hémihydratées et trihydratées ont des structures cristallines différentes qui sont intermédiaires entre les formes anhydres et dihydratées.
| Apparence | Poudre blanche ou solide |
| Gravité spécifique | 2,96 (anhydre), 2,32 (dihydraté) |
| Couleur | Blanc ou incolore |
| Odeur | Inodore |
| Masse molaire | 136,14 g/mole |
| Densité | 2,96 g/cm³ (anhydre), 2,32 g/cm³ (dihydraté) |
| Point de fusion | 1460°C (anhydre), 128°C (dihydraté) |
| Point d’ébullition | N’a pas de point d’ébullition défini |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 0,24 g/100 ml (20 °C) |
| Solubilité | Soluble dans l’eau et le glycérol, insoluble dans l’éthanol |
| La pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 9,8 (première dissociation), 11,8 (deuxième dissociation) |
| pH | 7 (neutre) |
Sécurité et dangers du sulfate de calcium
Le CaSO4 est généralement considéré comme sûr à utiliser et à manipuler, mais il peut présenter certains risques pour la santé s’il n’est pas manipulé correctement. L’inhalation de poussière de CaSO4 peut provoquer une irritation du système respiratoire, tandis que l’ingestion de grandes quantités du composé peut provoquer des troubles gastro-intestinaux. Le contact des yeux et de la peau avec le CaSO4 peut provoquer une irritation ou une sécheresse. Le CaSO4 peut également réagir avec certains produits chimiques pour produire des sous-produits dangereux. Par conséquent, un équipement de protection individuelle approprié doit être porté lors de la manipulation du CaSO4 et doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion. Provoque une irritation de la peau et des yeux. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2833.29.00 |
| Classe de danger | Non classé comme substance ou mélange dangereux selon le règlement (CE) n° 1272/2008 [CLP] |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) : > 2000 mg/kg |
Méthodes de synthèse du sulfate de calcium
Plusieurs méthodes permettent de synthétiser du CaSO4 en fonction de la forme souhaitée et de l’état d’hydratation du composé.
Une méthode courante consiste à faire réagir du carbonate de calcium ou de l’oxyde de calcium avec de l’acide sulfurique. La réaction produit respectivement du CaSO4 et du dioxyde de carbone ou de l’eau.
Une autre méthode implique la réaction du chlorure de calcium avec le sulfate de sodium , ce qui entraîne la précipitation du CaSO4. La déshydratation thermique du gypse, une forme minérale naturelle de CaSO4 dihydraté, produit du CaSO4.
Certains procédés industriels, tels que la désulfuration des gaz de combustion des centrales électriques, produisent du CaSO4 comme sous-produit. Au cours de ce processus, le dioxyde de soufre réagit avec le carbonate de calcium pour former du sulfite de calcium, qui subit une oxydation pour produire du CaSO4.
La méthode de synthèse utilisée pour le CaSO4 peut affecter ses propriétés, telles que la taille des particules, la cristallinité et la pureté. Il est donc important de choisir la méthode appropriée à l’application prévue du composé.
Utilisations du sulfate de calcium
Le CaSO4 a de nombreuses utilisations dans différentes industries en raison de ses propriétés uniques, notamment sa faible toxicité, son point de fusion élevé et sa couleur blanche. Certaines utilisations courantes du CaSO4 comprennent :
- Construction : Composant clé du ciment et des plaques de plâtre, où il agit comme liant et mastic.
- Aliments et boissons : Utilisé comme coagulant dans la production de tofu et comme agent raffermissant dans certains fromages et légumes en conserve.
- Produits pharmaceutiques : utilisés comme agent de remplissage et liant dans la production de comprimés et de capsules.
- Agriculture : Utilisé comme amendement du sol pour améliorer la structure du sol et augmenter le rendement des cultures.
- Produits chimiques : utilisés dans la production de divers produits chimiques, tels que les pigments, le papier et la transformation des textiles.
- Cosmétiques : Utilisé dans les formulations cosmétiques comme agent gonflant et opacifiant.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour éliminer les impuretés et réduire le tartre.
- Plastiques et caoutchouc : Utilisé comme agent de remplissage et de renforcement dans les produits en plastique et en caoutchouc.
Des questions:
Q : Le sulfate de calcium est-il végétalien ?
R : Oui, le CaSO4 est considéré comme végétalien car il ne provient pas de sources animales.
Q : Quelle était la principale utilisation du sulfate de calcium dans les hôpitaux ?
R : Le CaSO4 était couramment utilisé dans les hôpitaux comme plâtre pour les fractures osseuses.
Q : Quelles masses de sulfate de calcium et de phosphore ?
R : Cette question est incomplète et nécessite plus d’informations pour fournir une réponse spécifique.
Q : Le CaSO4 est-il soluble dans l’eau ?
R : Le CaSO4 a une faible solubilité dans l’eau, avec une solubilité d’environ 2,05 g/L à température ambiante.
Q : Le CaSO4 est-il soluble ?
R : Le sulfate de calcium a une faible solubilité dans l’eau, avec une solubilité d’environ 2,05 g/L à température ambiante.
Q : Quelle est la masse molaire du CaSO4 ?
R : La masse molaire du CaSO4 est d’environ 136,14 g/mol.
Q : Quel sel a un pH < 7 ? KBr, HCOOK, CaSO4, NH4NO3
R : Aucun des sels répertoriés n’a un pH < 7 sous sa forme pure. Cependant, une fois dissous dans l’eau, le NH4NO3 (nitrate d’ammonium) produira une solution acide avec un pH < 7.
