Le sulfate d’aluminium est un sel inorganique couramment utilisé comme agent coagulant dans les procédés de traitement de l’eau et comme agent floculant dans la purification des liquides.
| Nom UICPA | Sulfate d’aluminium |
| Formule moléculaire | Al2(SO4)3 |
| Numero CAS | 10043-01-3 |
| Synonymes | Sulfate d’aluminium, sulfate de diaaluminium, alun en tourteau, alun de papeterie, alun de filtre |
| InChI | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/h;;(H2,1,2,3,4)/q2+3;/p-3 |
Formule de sulfate d’aluminium
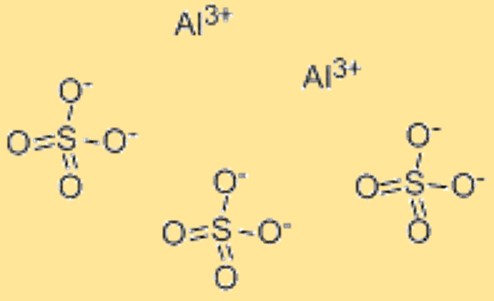
La formule chimique du sulfate d’aluminium est Al2(SO4)3. Cette formule représente le rapport des atomes dans le sulfate d’aluminium et est utilisée pour indiquer la composition du composé. La formule peut également être utilisée dans des calculs chimiques, tels que la détermination de la masse molaire ou du nombre de moles de sulfate d’aluminium dans un échantillon donné. La formule chimique du sulfate d’aluminium constitue un moyen pratique de représenter la composition du matériau et est largement reconnue dans la communauté scientifique. De plus, la formule peut être utilisée pour prédire les propriétés chimiques et physiques du sulfate d’aluminium, telles que sa solubilité dans l’eau, sa réactivité avec d’autres composés et sa stabilité dans différentes conditions.
Sulfate D’Aluminium Masse molaire
La masse molaire du sulfate d’aluminium est de 342,15 g/mol. Cette valeur est importante dans divers calculs chimiques et physiques, notamment la détermination des concentrations molaires, la stœchiométrie des réactions et la loi des gaz parfaits. La masse molaire est calculée en additionnant les poids atomiques de tous les atomes de la formule chimique du sulfate d’aluminium, qui est Al2(SO4)3. La masse molaire peut également être utilisée pour convertir la masse en nombre de moles pour un échantillon donné de sulfate d’aluminium.
Point d’ébullition du sulfate d’aluminium
Le point d’ébullition du sulfate d’aluminium n’est pas bien défini car il se décompose avant l’ébullition. Le sulfate d’aluminium est un sel hydraté et lorsqu’il est chauffé, il perd son eau d’hydratation et se décompose en oxyde d’aluminium et acide sulfurique. La température de décomposition peut varier de 120°C à 140°C, selon le degré d’hydratation. La présence d’impuretés dans l’échantillon peut également affecter la température de décomposition.
Point de fusion du sulfate d’aluminium
Le point de fusion du sulfate d’aluminium est d’environ 1 200°C. Cette température élevée est due aux fortes liaisons ioniques entre les ions aluminium et soufre. Le sulfate d’aluminium est un solide cristallin à température ambiante et possède une structure cristalline bien définie, ce qui contribue à son point de fusion élevé. Le point de fusion du sulfate d’aluminium est important pour déterminer les conditions de traitement requises pour la synthèse et la purification du matériau.
Densité du sulfate d’aluminium g/ml
La densité du sulfate d’aluminium est de 1,8 à 2,0 g/mL. Cette valeur peut varier en fonction du degré d’hydratation et de la présence d’impuretés dans l’échantillon. La densité du sulfate d’aluminium est une propriété physique importante qui peut être utilisée pour calculer le volume d’une masse donnée du matériau. La densité du sulfate d’aluminium est également utile pour déterminer la concentration d’une solution, car elle permet de calculer la masse de soluté par unité de volume de solvant.
Sulfate d’aluminium Poids moléculaire
Nous déterminons que le poids moléculaire du sulfate d’aluminium est de 342,15 g/mol en additionnant les poids atomiques de tous les atomes de sa formule chimique Al2(SO4)3. Cette valeur sert à la fois de poids moléculaire et de masse molaire et joue un rôle crucial dans les calculs chimiques, notamment la détermination des concentrations molaires et de la stœchiométrie des réactions.
Structure en sulfate d’aluminium
Le sulfate d’aluminium possède une structure cristalline composée de cations aluminium (Al3+) et d’anions sulfate (SO4^2-). Les cations aluminium se coordonnent avec six anions sulfate dans un arrangement hexagonal serré, maintenus ensemble par de fortes liaisons ioniques. La structure cristalline du sulfate d’aluminium influence ses propriétés physiques, telles que son point de fusion et sa solubilité.
| Apparence | Solide cristallin |
| Gravité spécifique | 1,8 à 2,0 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 342,15 g/mole |
| Densité | 1,8 à 2,0 g/ml |
| Point de fusion | 770°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | Pas bien défini |
| Densité de vapeur | Pas bien défini |
| pKa | Pas bien défini |
| pH | Neutre |
Sécurité et dangers du sulfate d’aluminium
Le sulfate d’aluminium est une substance dangereuse qui doit être manipulée avec précaution. L’inhalation de ses poussières peut provoquer une irritation des voies respiratoires et de la toux. Le contact avec la peau ou les yeux peut provoquer des rougeurs, des démangeaisons et des sensations de brûlure. L’ingestion de sulfate d’aluminium peut provoquer une irritation gastro-intestinale, notamment des nausées, des vomissements et de la diarrhée. S’il est ingéré en grande quantité, il peut entraîner des problèmes de santé plus graves, tels qu’une dépression du système nerveux central et des lésions rénales. Par conséquent, il est important de porter un équipement de protection individuelle, tel que des gants et des lunettes, lors de la manipulation du sulfate d’aluminium. De plus, la zone de travail doit être bien ventilée pour réduire le risque d’inhalation de poussière. En cas de contact avec la peau ou les yeux, la zone affectée doit être rincée abondamment à l’eau pendant au moins 15 minutes et des soins médicaux doivent être immédiatement recherchés.
| Symboles de danger | Xi – Irritant |
| Description de la sécurité | S24/25 – Éviter tout contact avec la peau et les yeux |
| Identifiants ONU | UN3077 – Danger pour l’environnement |
| Code SH | 2833.30.00 |
| Classe de danger | 8 – Substance corrosive |
| Groupe d’emballage | III |
| Toxicité | Toxicité faible à modérée en cas d’ingestion, d’inhalation ou de contact avec la peau ou les yeux |
Méthodes de synthèse du sulfate d’aluminium
Le sulfate d’aluminium peut être synthétisé par diverses méthodes, notamment la précipitation et la réaction avec l’acide sulfurique.
Une méthode de synthèse est la méthode de précipitation, qui consiste à mélanger une solution de sels d’aluminium avec de l’acide sulfurique. Cette réaction entraîne la formation de sulfate d’aluminium, qui précipite hors de la solution sous forme solide. Le solide peut ensuite être filtré, lavé et séché pour obtenir du sulfate d’aluminium pur.
Une autre méthode de synthèse est la méthode de réaction, qui consiste à mélanger de l’hydroxyde d’aluminium ou de l’oxyde d’aluminium avec de l’acide sulfurique. Cette réaction entraîne la formation de sulfate d’aluminium et d’eau. Le produit peut ensuite être purifié par lavage et séchage.
Dans les deux méthodes, la pureté du produit final peut être améliorée en utilisant des matières premières de haute pureté et en contrôlant soigneusement les conditions de la réaction. La pureté du sulfate d’aluminium peut être vérifiée en analysant ses propriétés physiques et chimiques, telles que sa masse molaire, son point de fusion et sa solubilité dans l’eau.
Dans l’ensemble, la synthèse du sulfate d’aluminium est un processus relativement simple qui peut être réalisé en laboratoire ou en milieu industriel, selon l’échelle de production souhaitée. Le choix de la méthode de synthèse dépendra de la disponibilité des matières premières, de la pureté souhaitée du produit et de l’échelle de production souhaitée.
Utilisations du sulfate d’aluminium
Les industries utilisent le sulfate d’aluminium pour sa polyvalence dans diverses applications telles que le traitement de l’eau, la production de papier et l’agriculture. Dans le traitement de l’eau, la substance agit comme un coagulant et purifie l’eau potable en provoquant l’agrégation des impuretés et la formation de particules plus grosses qui peuvent être facilement filtrées. L’industrie de la production de papier utilise le sulfate d’aluminium comme charge et liant pour améliorer la résistance et la brillance du papier et réguler les niveaux de pH dans la pâte. En agriculture, le sulfate d’aluminium abaisse le pH du sol et augmente l’acidité, fournissant ainsi aux plantes des nutriments essentiels tels que le soufre et l’aluminium. Le sulfate d’aluminium a également d’autres utilisations, notamment le tannage du cuir, l’ignifugation des textiles et comme floculant dans le traitement des eaux usées. Ainsi, le sulfate d’aluminium joue un rôle important dans la vie moderne en servant à plusieurs fins dans diverses industries.
Des questions:
Quelle est la formule du sulfate d’aluminium ?
La formule chimique du sulfate d’aluminium est Al2(SO4)3.
Le sulfate d’aluminium est-il soluble ?
Oui, le sulfate d’aluminium est soluble dans l’eau. Il se dissout dans l’eau pour former une solution d’ions aluminium, sulfate et hydroxyde. La solubilité du sulfate d’aluminium dans l’eau dépend de la température, ce qui signifie qu’il est plus soluble à des températures plus élevées et moins soluble à des températures plus basses. À température ambiante, le sulfate d’aluminium est facilement soluble dans l’eau, avec une solubilité d’environ 20 grammes pour 100 millilitres d’eau.
