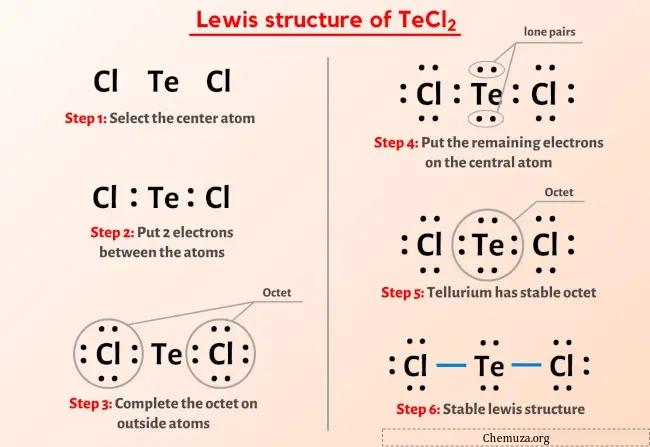
Vous avez donc déjà vu l’image ci-dessus, n’est-ce pas ?
Laissez-moi vous expliquer brièvement l’image ci-dessus.
La structure TeCl2 Lewis a un atome de tellure (Te) au centre qui est entouré de deux atomes de chlore (Cl). Il existe 2 liaisons simples entre l’atome de tellure (Te) et chaque atome de chlore (Cl). Il y a 2 paires libres sur l’atome de tellure (Te) et 3 paires libres sur les deux atomes de chlore (Cl).
Si vous n’avez rien compris de l’image ci-dessus de la structure de Lewis de TeCl2, alors restez avec moi et vous obtiendrez l’explication détaillée étape par étape sur le dessin d’une structure de Lewis de TeCl2 .
Passons donc aux étapes de dessin de la structure de Lewis de TeCl2.
Étapes de dessin de la structure TeCl2 Lewis
Étape 1 : Trouver le nombre total d’électrons de valence dans la molécule TeCl2
Afin de trouver le nombre total d’électrons de valence dans une molécule TeCl2, vous devez tout d’abord connaître les électrons de valence présents dans l’atome de tellure ainsi que dans l’atome de chlore.
(Les électrons de valence sont les électrons présents sur l’ orbite la plus externe de tout atome.)
Ici, je vais vous expliquer comment trouver facilement les électrons de valence du tellure ainsi que du chlore à l’aide d’un tableau périodique.
Total des électrons de valence dans la molécule TeCl2
→ Électrons de Valence donnés par l’atome de tellure :
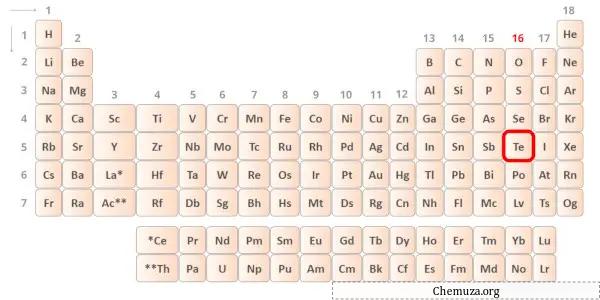
Le tellure est un élément du groupe 16 du tableau périodique. [1] Par conséquent, les électrons de valence présents dans le tellure sont 6 .
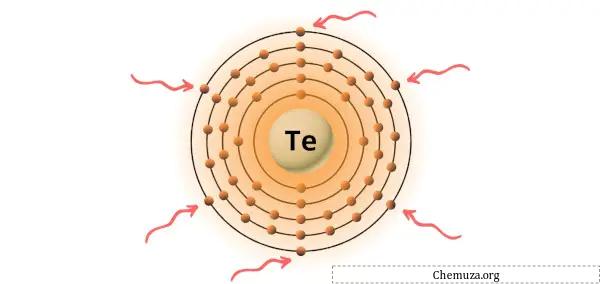
Vous pouvez voir les 6 électrons de valence présents dans l’atome de tellure, comme le montre l’image ci-dessus.
→ Électrons de Valence donnés par l’atome de chlore :

Le chlore est un élément du groupe 17 du tableau périodique. [2] Par conséquent, les électrons de valence présents dans le chlore sont 7 .
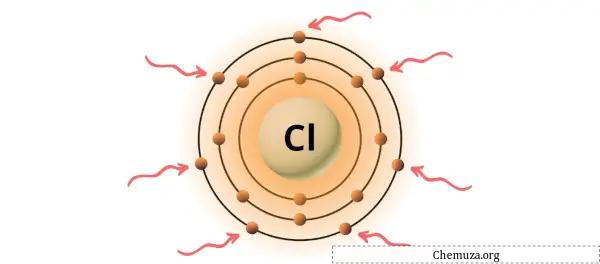
Vous pouvez voir les 7 électrons de valence présents dans l’atome de chlore, comme le montre l’image ci-dessus.
Ainsi,
Total des électrons de valence dans la molécule TeCl2 = électrons de valence donnés par 1 atome de tellure + électrons de valence donnés par 2 atomes de chlore = 6 + 7(2) = 20 .
Étape 2 : Sélectionnez l’atome central
Pour sélectionner l’atome central, il faut se rappeler que l’atome le moins électronégatif reste au centre.
Maintenant, ici, la molécule donnée est TeCl2 et elle contient des atomes de tellure (Te) et des atomes de chlore (Cl).
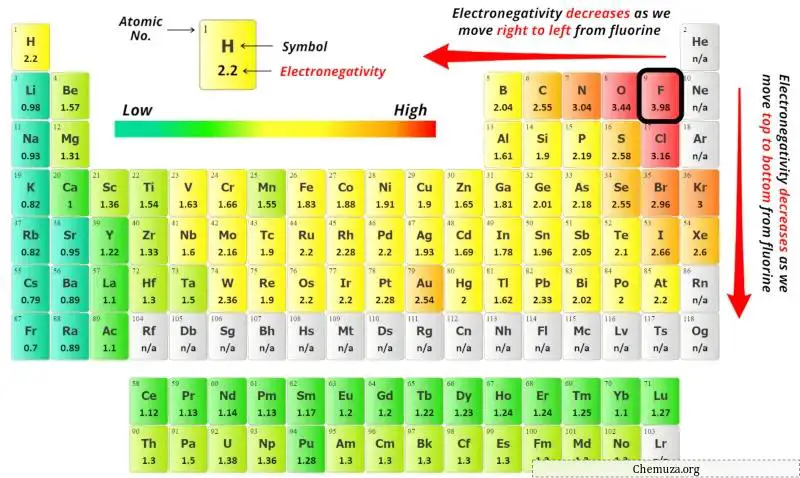
Vous pouvez voir les valeurs d’électronégativité de l’atome de tellure (Te) et de l’atome de chlore (Cl) dans le tableau périodique ci-dessus.
Si nous comparons les valeurs d’électronégativité du tellure (Te) et du chlore (Cl), alors l’ atome de tellure est moins électronégatif .
Ici, l’atome de tellure (Te) est l’atome central et les atomes de chlore (Cl) sont les atomes extérieurs.

Étape 3 : Connectez chaque atome en plaçant une paire d’électrons entre eux
Maintenant dans la molécule TeCl2, il faut mettre les paires d’électrons entre l’atome de tellure (Te) et les atomes de chlore (Cl).

Cela indique que le tellure (Te) et le chlore (Cl) sont chimiquement liés l’un à l’autre dans une molécule TeCl2.
Étape 4 : Rendre les atomes externes stables. Placez la paire d’électrons de valence restante sur l’atome central.
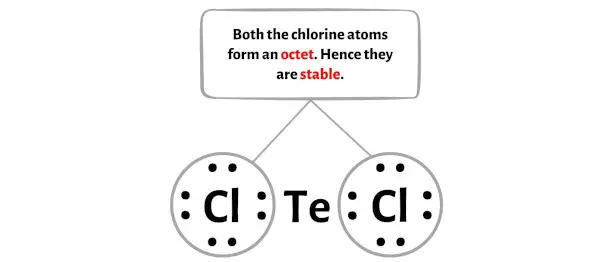
Dans cette étape, vous devez vérifier la stabilité des atomes externes.
Ici, sur le croquis de la molécule TeCl2, vous pouvez voir que les atomes externes sont des atomes de chlore.
Ces atomes de chlore externes forment un octet et sont donc stables.
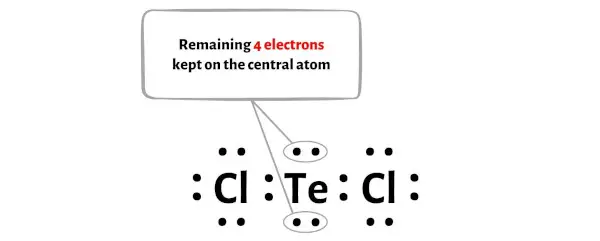
De plus, à l’étape 1, nous avons calculé le nombre total d’électrons de valence présents dans la molécule TeCl2.
La molécule TeCl2 possède un total de 20 électrons de valence et parmi ceux-ci, seuls 16 électrons de valence sont utilisés dans le schéma ci-dessus.
Donc le nombre d’électrons restants = 20 – 16 = 4 .
Vous devez placer ces 4 électrons sur l’atome central de tellure dans le schéma ci-dessus de la molécule TeCl2.
Passons maintenant à l’étape suivante.
Étape 5 : Vérifiez l’octet sur l’atome central
Dans cette étape, vous devez vérifier si l’atome central de tellure (Te) est stable ou non.
Afin de vérifier la stabilité de l’atome central de chlore (Cl), nous devons vérifier s’il forme un octet ou non.
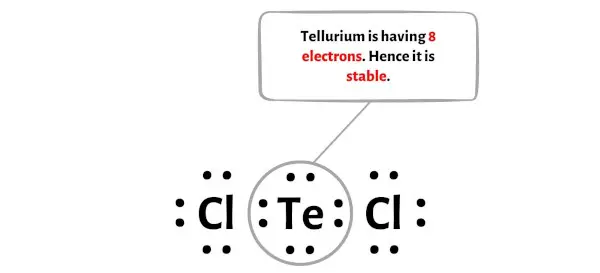
Vous pouvez voir sur l’image ci-dessus que l’atome de tellure forme un octet. Cela signifie qu’il possède 8 électrons.
Et donc l’atome central de tellure est stable.
Passons maintenant à la dernière étape pour vérifier si la structure de Lewis de TeCl2 est stable ou non.
Étape 6 : Vérifier la stabilité de la structure Lewis
Vous êtes maintenant arrivé à la dernière étape dans laquelle vous devez vérifier la stabilité de la structure de Lewis de TeCl2.
La stabilité de la structure Lewis peut être vérifiée en utilisant un concept de charge formelle .
Bref, il faut maintenant trouver la charge formelle des atomes de tellure (Te) ainsi que des atomes de chlore (Cl) présents dans la molécule TeCl2.
Pour calculer la taxe formelle, vous devez utiliser la formule suivante :
Charge formelle = Électrons de Valence – (Électrons de liaison)/2 – Électrons non liants
Vous pouvez voir le nombre d’ électrons liants et d’électrons non liants pour chaque atome de la molécule TeCl2 dans l’image ci-dessous.
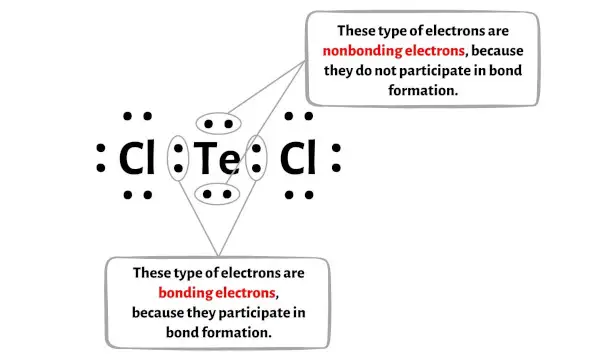
Pour l’atome de tellure (Te) :
Électrons de Valence = 6 (car le tellure est dans le groupe 16)
Électrons de liaison = 4
Électrons non liants = 4
Pour l’atome de chlore (Cl) :
Électron de Valence = 7 (car le chlore est dans le groupe 17)
Électrons de liaison = 2
Électrons non liants = 6
| Accusation formelle | = | électrons de valence | – | (Electrons de liaison)/2 | – | Électrons non liants | ||
| Te | = | 6 | – | 4/2 | – | 4 | = | 0 |
| Cl | = | 7 | – | 2/2 | – | 6 | = | 0 |
À partir des calculs de charge formelle ci-dessus, vous pouvez voir que l’atome de tellure (Te) ainsi que l’atome de chlore (Cl) ont une charge formelle « nulle » .
Cela indique que la structure de Lewis ci-dessus de TeCl2 est stable et qu’il n’y a aucun autre changement dans la structure ci-dessus de TeCl2.
Dans la structure de points de Lewis ci-dessus de TeCl2, vous pouvez également représenter chaque paire d’électrons de liaison (:) comme une liaison simple (|). Ce faisant, vous obtiendrez la structure de Lewis suivante de TeCl2.
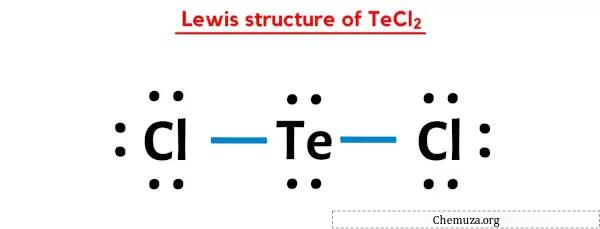
J’espère que vous avez complètement compris toutes les étapes ci-dessus.
Pour plus de pratique et une meilleure compréhension, vous pouvez essayer d’autres structures de Lewis répertoriées ci-dessous.
Essayez (ou au moins voyez) ces structures de Lewis pour une meilleure compréhension :
