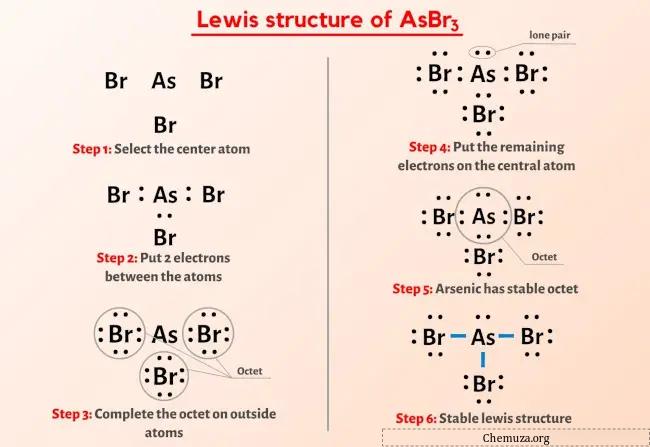
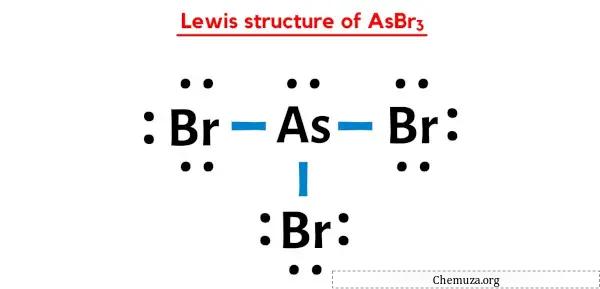
Vous avez donc déjà vu l’image ci-dessus, n’est-ce pas ?
Laissez-moi vous expliquer brièvement l’image ci-dessus.
La structure AsBr3 Lewis a un atome d’arsenic (As) au centre qui est entouré de trois atomes de brome (Br). Il existe 3 liaisons simples entre l’atome d’arsenic (As) et chaque atome de brome (Br). Il y a 1 paire libre sur l’atome d’arsenic (As) et 3 paires libres sur les trois atomes de brome (Br).
Si vous n’avez rien compris de l’image ci-dessus de la structure de Lewis d’AsBr3, alors restez avec moi et vous obtiendrez l’explication détaillée étape par étape sur le dessin d’une structure de Lewis d’ AsBr3 .
Passons donc aux étapes de dessin de la structure de Lewis d’AsBr3.
Étapes de dessin de la structure AsBr3 Lewis
Étape 1 : Trouver le nombre total d’électrons de valence dans la molécule AsBr3
Afin de trouver le nombre total d’électrons de valence dans la molécule AsBr3, vous devez tout d’abord connaître les électrons de valence présents dans l’atome d’arsenic ainsi que dans l’atome de brome.
(Les électrons de valence sont les électrons présents sur l’ orbite la plus externe de tout atome.)
Ici, je vais vous expliquer comment trouver facilement les électrons de valence de l’arsenic ainsi que du brome à l’aide d’un tableau périodique.
Total des électrons de valence dans la molécule AsBr3
→ Électrons de Valence donnés par l’atome d’arsenic :
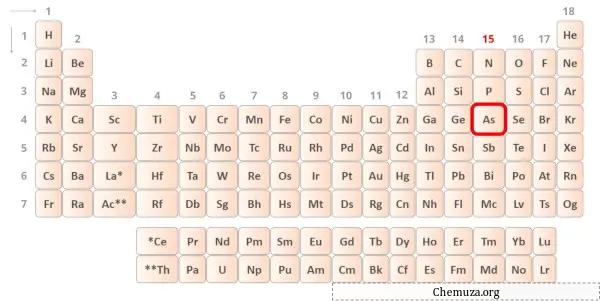
L’arsenic est un élément du groupe 15 du tableau périodique. [1] Par conséquent, les électrons de valence présents dans l’arsenic sont 5 .
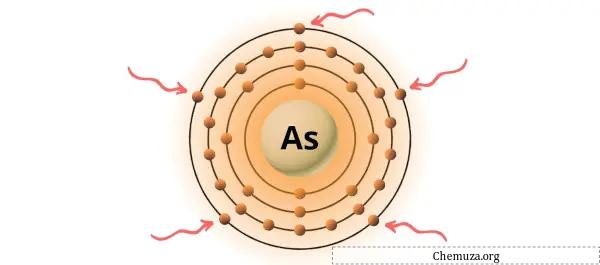
Vous pouvez voir les 5 électrons de valence présents dans l’atome d’arsenic comme le montre l’image ci-dessus.
→ Électrons de Valence donnés par l’atome de brome :
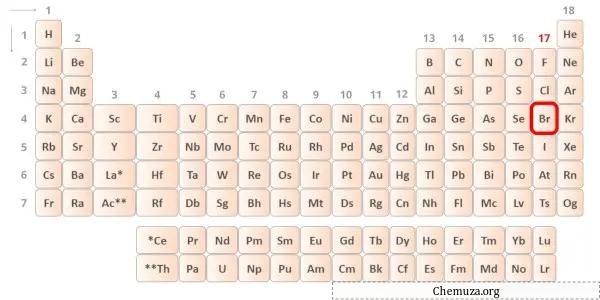
Le brome est un élément du groupe 17 du tableau périodique. [2] Par conséquent, les électrons de valence présents dans le brome sont 7 .
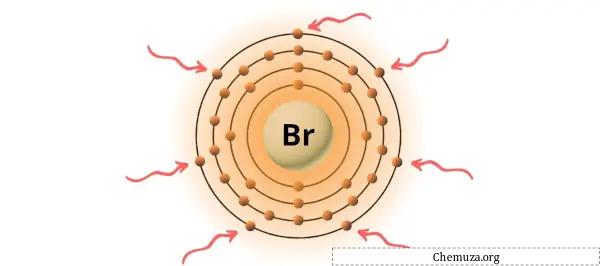
Vous pouvez voir les 7 électrons de valence présents dans l’atome de brome, comme le montre l’image ci-dessus.
Ainsi,
Total des électrons de valence dans la molécule AsBr3 = électrons de valence donnés par 1 atome d’arsenic + électrons de valence donnés par 3 atomes de brome = 5 + 7(3) = 26 .
Étape 2 : Sélectionnez l’atome central
Pour sélectionner l’atome central, il faut se rappeler que l’atome le moins électronégatif reste au centre.
Maintenant, ici, la molécule donnée est AsBr3 et elle contient des atomes d’arsenic (As) et des atomes de brome (Br).
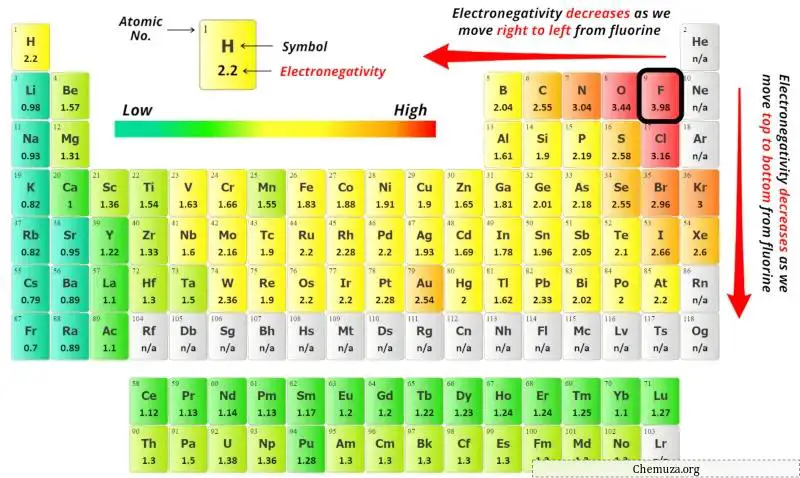
Vous pouvez voir les valeurs d’électronégativité de l’atome d’arsenic (As) et de l’atome de brome (Br) dans le tableau périodique ci-dessus.
Si l’on compare les valeurs d’électronégativité de l’arsenic (As) et du brome (Br), alors l’ atome d’arsenic est moins électronégatif .
Ici, l’atome d’arsenic (As) est l’atome central et les atomes de brome (Br) sont les atomes extérieurs.
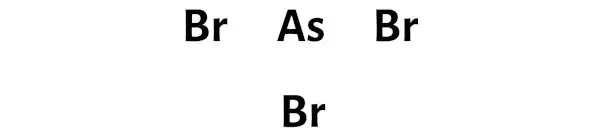
Étape 3 : Connectez chaque atome en plaçant une paire d’électrons entre eux
Maintenant dans la molécule AsBr3, il faut mettre les paires d’électrons entre l’atome d’arsenic (As) et les atomes de brome (Br).
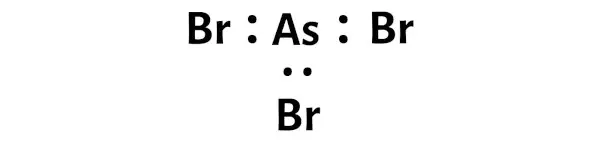
Cela indique que l’arsenic (As) et le brome (Br) sont chimiquement liés l’un à l’autre dans une molécule AsBr3.
Étape 4 : Rendre les atomes externes stables. Placez la paire d’électrons de valence restante sur l’atome central.
Dans cette étape, vous devez vérifier la stabilité des atomes externes.
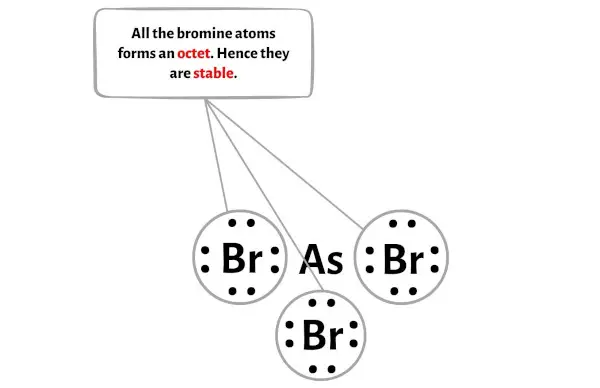
Ici, sur le croquis de la molécule AsBr3, vous pouvez voir que les atomes externes sont des atomes de brome.
Ces atomes de brome externes forment un octet et sont donc stables.
De plus, à l’étape 1, nous avons calculé le nombre total d’électrons de valence présents dans la molécule AsBr3.
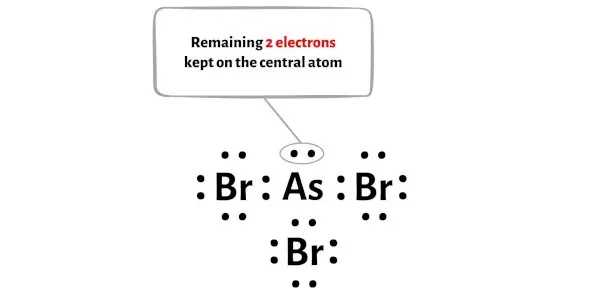
La molécule AsBr3 possède un total de 26 électrons de valence et parmi ceux-ci, seuls 24 électrons de valence sont utilisés dans le schéma ci-dessus.
Donc le nombre d’électrons restants = 26 – 24 = 2 .
Vous devez placer ces 2 électrons sur l’atome central d’arsenic dans le schéma ci-dessus de la molécule AsBr3.
Passons maintenant à l’étape suivante.
Étape 5 : Vérifiez l’octet sur l’atome central
Dans cette étape, vous devez vérifier si l’atome central d’arsenic (As) est stable ou non.
Afin de vérifier la stabilité de l’atome central d’arsenic (As), nous devons vérifier s’il forme un octet ou non.
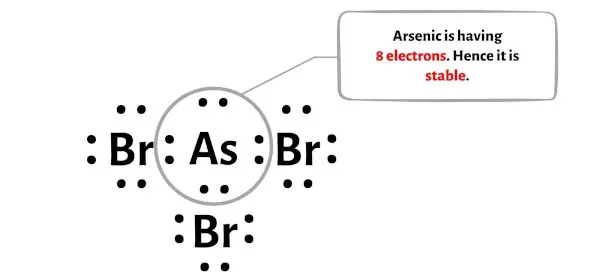
Vous pouvez voir sur l’image ci-dessus que l’atome d’arsenic forme un octet. Cela signifie qu’il possède 8 électrons.
Et donc l’atome central d’arsenic est stable.
Passons maintenant à la dernière étape pour vérifier si la structure de Lewis d’AsBr3 est stable ou non.
Étape 6 : Vérifier la stabilité de la structure Lewis
Vous êtes maintenant arrivé à la dernière étape dans laquelle vous devez vérifier la stabilité de la structure de Lewis d’AsBr3.
La stabilité de la structure Lewis peut être vérifiée en utilisant un concept de charge formelle .
Bref, il faut maintenant trouver la charge formelle des atomes d’arsenic (As) ainsi que des atomes de brome (Br) présents dans la molécule AsBr3.
Pour calculer la taxe formelle, vous devez utiliser la formule suivante :
Charge formelle = Électrons de Valence – (Électrons de liaison)/2 – Électrons non liants
Vous pouvez voir le nombre d’ électrons liants et d’électrons non liants pour chaque atome de la molécule AsBr3 dans l’image ci-dessous.
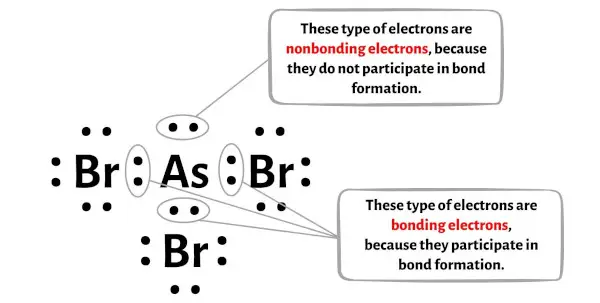
Pour l’atome d’arsenic (As) :
Électrons de Valence = 5 (car l’arsenic est dans le groupe 15)
Électrons de liaison = 6
Électrons non liants = 2
Pour l’atome de brome (Br) :
Électrons de Valence = 7 (car le brome est dans le groupe 17)
Électrons de liaison = 2
Électrons non liants = 6
| Accusation formelle | = | électrons de valence | – | (Electrons de liaison)/2 | – | Électrons non liants | ||
| Comme | = | 5 | – | 6/2 | – | 2 | = | 0 |
| Br | = | 7 | – | 2/2 | – | 6 | = | 0 |
À partir des calculs de charge formelle ci-dessus, vous pouvez voir que l’atome d’arsenic (As) ainsi que l’atome de brome (Br) ont une charge formelle « nulle » .
Cela indique que la structure de Lewis ci-dessus d’AsBr3 est stable et qu’il n’y a aucun autre changement dans la structure ci-dessus d’AsBr3.
Dans la structure de points de Lewis ci-dessus d’AsBr3, vous pouvez également représenter chaque paire d’électrons de liaison (:) comme une liaison simple (|). Ce faisant, vous obtiendrez la structure de Lewis suivante d’AsBr3.
J’espère que vous avez complètement compris toutes les étapes ci-dessus.
Pour plus de pratique et une meilleure compréhension, vous pouvez essayer d’autres structures de Lewis répertoriées ci-dessous.
Essayez (ou au moins voyez) ces structures de Lewis pour une meilleure compréhension :
