Этилбензол (C8H10) — органическое соединение со сладким запахом. Его используют в качестве растворителя в различных отраслях промышленности, включая производство пластмасс и резины. Он также содержится в бензине и используется в составе некоторых бытовых товаров.
| Название ИЮПАК | Этилбензол |
| Молекулярная формула | C8H10 |
| Количество CAS | 100-41-4 |
| Синонимы | Этилбензол, ЭБ, фенилэтан, этилфенил, 2-фенилэтан, альфа-метилтолуол, 1-фенилэтан, этилбензол, разбавитель стирола. |
| ИнЧИ | ИнЧИ=1S/C8H10/c1-2-8-6-4-3-5-7-8/h3-7H,2H2,1H3 |
Свойства этилбензола
Формула этилбензола
Молекулярная формула этилбензола — C8H10, что означает, что он состоит из восьми атомов углерода и десяти атомов водорода. Химическая структура этилбензола представляет собой бензольное кольцо, присоединенное к этильной группе.
Этилбензол Молярная масса
Молярная масса C8H10 составляет 106,17 г/моль. Это рассчитывается путем сложения атомных масс всех атомов молекулы C8H10.
Температура кипения этилбензола
Температура кипения C8H10 составляет 136,2°C (277,2°F). Это температура, при которой жидкая форма C8H10 превращается в газ. C8H10 имеет относительно низкую температуру кипения по сравнению с другими ароматическими углеводородами, что делает его полезным в качестве растворителя в различных отраслях промышленности.
Температура плавления этилбензола
Температура плавления C8H10 составляет -95,2°C (-139,4°F). Это температура, при которой твердая форма C8H10 превращается в жидкость. C8H10 имеет относительно низкую температуру плавления по сравнению с другими ароматическими углеводородами, что делает его полезным в качестве сырья для производства других химических веществ.
Плотность этилбензола, г/мл
Плотность C8H10 составляет 0,867 г/мл при 20°C (68°F). Это означает, что один миллилитр C8H10 при этой температуре весит 0,867 грамма. C8H10 менее плотен, чем вода, а это означает, что он будет плавать на поверхности воды, если смешать две жидкости.
Этилбензол Молекулярный вес
Молекулярная масса C8H10 составляет 106,17 г/моль. Это масса молекулы C8H10, которую можно рассчитать, сложив атомные массы всех атомов молекулы.
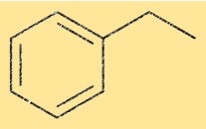
Структура этилбензола
Структура C8H10 состоит из бензольного кольца, присоединенного к этильной группе. Этильная группа присоединена к одному из атомов углерода бензольного кольца. Эта структура также известна как фенилэтан.
Растворимость этилбензола
C8H10 нерастворим в воде, но растворим в органических растворителях, таких как спирты, эфиры и хлороформ. Это означает, что C8H10 не растворяется в воде, а растворяется в других жидкостях со схожими химическими свойствами. Растворимость C8H10 в различных растворителях зависит от таких факторов, как температура, давление и химические свойства растворителя.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,867 г/мл при 20°С |
| Цвет | Бесцветный |
| Запах | Сладкий аромат |
| Молярная масса | 106,17 г/моль |
| Плотность | 0,867 г/мл при 20°С |
| Точка плавления | -95,2°C (-139,4°F) |
| Точка кипения | 136,2°С (277,2°Ф) |
| Мигающая точка | 11,1°С (52°Ф) |
| Растворимость в воде | 0,30 г/л при 20°C |
| Растворимость | Растворим в органических растворителях, таких как спирты, эфиры и хлороформ. |
| Давление газа | 10,7 мм рт.ст. при 20°C |
| Плотность пара | 3.7 |
| пКа | 10.17 |
| рН | Непригодный |
Безопасность и опасность этилбензола
C8H10 может быть опасен, если не принять надлежащие меры предосторожности при обращении и использовании. Он классифицируется как легковоспламеняющаяся жидкость и может воспламениться при воздействии тепла или пламени. C8H10 также может быть вредным при вдыхании или проглатывании. Воздействие высоких концентраций C8H10 может вызвать головокружение, головные боли и раздражение дыхательных путей. Длительное воздействие C8H10 связано с повреждением печени и почек. При работе с C8H10 следует соблюдать меры безопасности, например, носить защитную одежду и перчатки, работать в хорошо проветриваемых помещениях и хранить его в безопасном, прохладном и сухом месте.
| Символы опасности | Легковоспламеняющийся, вредный |
| Описание безопасности | Храните вдали от источников тепла, искр, открытого огня и горячих поверхностей. Используйте взрывозащищенное оборудование. Избегайте вдыхания пыли/дыма/газа/тумана/паров/спрей. Тщательно промойте после обработки. |
| Идентификационные номера ООН | ООН 1175 |
| код ТН ВЭД | 2902.90.20 |
| Класс опасности | 3 (Горючие жидкости) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Этилбензол считается умеренно токсичным веществом. При длительном воздействии или в высоких концентрациях он может вызвать раздражение глаз и кожи, проблемы с дыханием и повреждение нервной системы. |
Методы синтеза этилбензола
Наиболее часто используемый метод синтеза C8H10 — каталитическое дегидрирование этилциклогексана. Этот процесс включает нагревание смеси этилциклогексана и газообразного водорода над катализатором при высокой температуре, что приводит к отделению атомов водорода от этильной группы, что приводит к образованию C8H10.
Другой метод синтеза C8H10 включает алкилирование бензола газообразным этиленом . Эта реакция требует катализатора, обычно хлорида алюминия, и приводит к образованию C8H10 и хлористого водорода в качестве побочного продукта.
Альтернативный метод получения C8H10 включает реакцию бензола с этилхлоридом в присутствии катализатора на основе кислоты Льюиса, такого как хлорид алюминия. Этот процесс приводит к образованию C8H10 и хлористого водорода в качестве побочного продукта.
Помимо упомянутых методов, исследователи также разрабатывают новые методы синтеза C8H10, такие как использование ионных жидкостей в качестве растворителя для алкилирования бензола этиленом . Эти методы потенциально могут предложить преимущества с точки зрения эффективности и экологической устойчивости. Однако их промышленное использование пока не получило широкого распространения.
Использование этилбензола
C8H10 имеет несколько важных применений в различных отраслях промышленности. Некоторые из его основных применений:
- Производство стирола: Производство стирола, который используется для производства различных пластмасс, смол и синтетического каучука, связанного с C8H10 в качестве ключевого промежуточного продукта.
- Растворитель: обычно используется в качестве растворителя для различных применений, включая чернила, покрытия, клеи и чистящие средства.
- Топливная присадка: добавляется в бензин для повышения его октанового числа, что может улучшить работу двигателя.
- Химическое промежуточное соединение: используется в качестве сырья для синтеза других химических веществ, таких как фенилэтанол и диэтилбензол.
- Производство полимеров: используется в производстве различных видов полимеров, таких как полистирол и акрилонитрил-бутадиен-стирольные (АБС) смолы.
- Сельское хозяйство: Также используется в качестве пестицида и гербицида.
- Медицинское применение: используется в качестве местного анестетика, а также растворителя для фармацевтических продуктов.
Вопросы:
Вопрос: Сколько сигналов вы ожидаете увидеть в спектре ЯМР 1Н этилбензола?
A: Спектр ЯМР 1H для C8H10 будет иметь четыре сигнала: два для протонов бензольного кольца (которые будут выглядеть как дублет) и два для протонов этильной группы (которые будут выглядеть как триплет).
Вопрос: В каких пропорциях следует смешивать бензол и этилбензол?
Ответ: Пропорции бензола и C8H10 для смешивания зависят от желаемой концентрации C8H10 в смеси. Соотношение бензол/C8H10 может варьироваться от 10:1 до 1:1, в зависимости от применения.
Вопрос: Что такое нитрование этилбензола?
A: Нитрование C8H10 включает реакцию C8H10 со смесью азотной и серной кислот, приводящую к введению одной или нескольких нитрогрупп в бензольное кольцо C8H10. Эта реакция обычно используется при производстве промышленных химикатов, таких как нитробензол и фенилэтиламины.
Вопрос: Полярен ли этилбензол?
Ответ: C8H10 является неполярным соединением из-за симметричного строения бензольного кольца, которое сводит на нет любую полярность этильной группы. В результате C8H10 плохо растворяется в воде и обычно растворим в неполярных растворителях, таких как гексан и толуол.
Вопрос: Как перейти с этилбензола на стирол?
Ответ: C8H10 можно превратить в стирол посредством процесса дегидрирования, который включает удаление двух атомов водорода из этильной группы с использованием такого катализатора, как оксид железа или оксид хрома. Этот процесс приводит к образованию стирола и газообразного водорода в качестве побочного продукта. Полученный стирол затем можно очистить и использовать в производстве различных промышленных материалов, таких как пластмассы, смолы и синтетический каучук.
