Четыреххлористый углерод — бесцветная жидкость со сладким запахом. Он широко использовался в качестве растворителя, но его производство и использование сократились из-за его вредного воздействия на здоровье и окружающую среду.
| Название ИЮПАК | Тетрахлорметан |
| Молекулярная формула | CCl4 |
| Количество CAS | 56-23-5 |
| Синонимы | Тет углерода, тетраформ, перхлорметан, тетразол |
| ИнЧИ | InChI=1S/CCl4/c2-1(3,4)5 |
Свойства четыреххлористого углерода
Формула четыреххлористого углерода
Химическая формула четыреххлористого углерода: CCl4. Он представляет собой молекулу, состоящую из атома углерода, связанного с четырьмя атомами хлора. Формула предоставляет важную информацию об элементном составе и расположении атомов внутри соединения.
Молярная масса тетрахлорида углерода
Молярную массу тетрахлорметана рассчитывают путем сложения атомных масс составляющих его элементов. Углерод имеет молярную массу 12,01 г/моль, а молярная масса хлора составляет 35,45 г/моль. Сложив эти значения, молярная масса тетрахлорметана составит примерно 153,82 г/моль.
Температура кипения четыреххлористого углерода
Тетрахлорметан имеет относительно высокую температуру кипения — 76,72°C (170,1°F). Это означает, что при стандартном атмосферном давлении соединение переходит из жидкости в газ при этой температуре. Температура кипения отражает силу межмолекулярных сил внутри вещества.
Четыреххлористый углерод. Температура плавления.
Температура плавления тетрахлорметана составляет -22,92°C (-9,26°F). Это температура, при которой твердая форма соединения превращается в жидкость. Температура плавления дает представление о силе связей, которые удерживают атомы вместе внутри кристаллической решетки.
Плотность четыреххлористого углерода г/мл
Плотность тетрахлорметана составляет примерно 1,586 г/мл. Плотность относится к массе вещества в единице объема. Плотность тетрахлорметана указывает на то, что он плотнее воды, плотность которой составляет 1 г/мл.
Молекулярный вес тетрахлорида углерода
Молекулярная масса тетрахлорметана рассчитывается путем сложения атомных масс составляющих его атомов. Молекулярная масса тетрахлорметана с одним атомом углерода (12,01 г/моль) и четырьмя атомами хлора (по 35,45 г/моль) составляет примерно 153,82 г/моль.
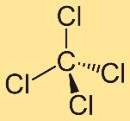
Структура четыреххлористого углерода
Структура тетрахлорметана состоит из центрального атома углерода, связанного с четырьмя атомами хлора. Эти атомы хлора расположены симметрично вокруг атома углерода, образуя тетраэдрическую геометрию. Эта структура влияет на свойства и поведение соединения.
Растворимость четыреххлористого углерода
Тетрахлорметан плохо растворяется в воде, его растворимость составляет около 0,8 г/л при 20°C. Однако он проявляет более высокую растворимость в органических растворителях, таких как этанол, эфир и бензол. На характеристики растворимости влияют межмолекулярные силы и полярность участвующих веществ.
| Появление | Бесцветная жидкость |
| Удельный вес | 1586 |
| Цвет | Н/Д |
| Запах | Мягкий |
| Молярная масса | 153,82 г/моль |
| Плотность | 1586 г/мл |
| Точка плавления | -22,92°C (-9,26°F) |
| Точка кипения | 76,72°С (170,1°Ф) |
| Мигающая точка | Н/Д |
| Растворимость в воде | 0,8 г/л при 20°C |
| Растворимость | Растворим в органических растворителях, таких как этанол, эфир и бензол. |
| Давление газа | 11,9 мм рт.ст. при 20°C |
| Плотность пара | 5,3 (воздух = 1) |
| пКа | Н/Д |
| рН | Н/Д |
Безопасность и опасности четыреххлористого углерода
Тетрахлорметан представляет значительную угрозу безопасности. Он считается высокотоксичным и может нанести серьезный вред здоровью человека. Вдыхание его паров может вызвать раздражение дыхательных путей, головокружение, тошноту и даже повреждение печени и почек. Контакт кожи с жидкостью может вызвать ожоги и раздражения. Это соединение также является известным канцерогеном, представляющим долгосрочный риск для здоровья. Кроме того, тетрахлорметан опасен для окружающей среды, поскольку может загрязнять почву и воду. Из-за этих опасностей его производство и использование были значительно ограничены, чтобы свести к минимуму воздействие и защитить здоровье человека и окружающую среду. Для снижения рисков, связанных с тетрахлорметаном, следует соблюдать надлежащие протоколы обращения, хранения и утилизации.
| Символы опасности | Т, Хн |
| Описание безопасности | Очень токсичен; Вредный |
| Идентификационные номера ООН | 1846 год |
| код ТН ВЭД | 2903.14.0000 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II |
| Токсичность | Острая токсичность, Канцерогенный |
Методы синтеза четыреххлористого углерода
Тетрахлорметан можно синтезировать разными методами. Распространенный метод включает реакцию между газообразным хлором (Cl2) и сероуглеродом (CS2) в присутствии катализатора, такого как хлорид алюминия (AlCl3).
В этом процессе газообразный хлор реагирует с парами сероуглерода с образованием тетрахлорметана и серы. Реакция протекает следующим образом:
Cl2 + CS2 → CCl4 + S
Другой метод включает реакцию между метаном (CH4) и газообразным хлором. В контролируемых условиях метан реагирует с хлором в присутствии ультрафиолетового (УФ) света или тепла с образованием тетрахлорметана и хлористого водорода. Реакция протекает следующим образом:
CH4 + 4Cl2 → CCl4 + 4HCl
Хлорирование сероуглерода с использованием хлористого водорода (HCl) в качестве хлорирующего агента дает тетрахлорметан. Для этой реакции требуется катализатор, такой как хлорид железа (III) (FeCl3). Реакция протекает следующим образом:
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
При синтезе тетрахлорметана следует проявлять осторожность из-за опасной природы соединения. Они должны использовать строгие меры безопасности и соответствующее оборудование для обеспечения своего благополучия и предотвращения загрязнения окружающей среды.
Использование четыреххлористого углерода
В различных приложениях использовались уникальные свойства тетрахлорметана. Вот некоторые из его применений:
- Растворитель: Тетрахлорметан растворяет масла, смазки, резину и воски, выступая в качестве растворителя. Однако его токсичность и экологические проблемы значительно сократили использование растворителей.
- Огнетушитель: Тетрахлорметан, используемый для тушения определенных типов пожаров, связанных с электрическим оборудованием и легковоспламеняющимися жидкостями. Более безопасные альтернативы и их вредные последствия привели к постепенному отказу от их использования.
- Химическое промежуточное соединение: Тетрахлорметан служил химическим промежуточным продуктом при производстве различных соединений, таких как хладагенты, пестициды и фармацевтические препараты.
- Чистящее средство: ранее в промышленности использовался тетрахлорметан в качестве чистящего средства для металлических поверхностей и электронных компонентов. Однако риски для здоровья и окружающей среды привели к предпочтению более безопасных альтернатив.
- Лабораторный реагент: Тетрахлорметан иногда используется в качестве реагента или растворителя для конкретных реакций и экстракций в лаборатории. Химики обычно предпочитают более безопасные альтернативы и ограничивают их использование.
Крайне важно отметить, что многие из этих применений сократились или даже вообще прекратились из-за вредного воздействия тетрахлорметана на здоровье человека и окружающую среду. Следовательно, использование тетрахлорметана значительно сократилось, а в различных отраслях промышленности стали внедряться альтернативные вещества, менее токсичные и менее вредные для окружающей среды.
Вопросы:
Вопрос: Можно ли по-прежнему покупать заменители четыреххлористого углерода?
Ответ: Да, существуют заменители тетрахлорметана, которые более безопасны и оказывают меньшее воздействие на окружающую среду.
Вопрос: Можно ли еще купить четыреххлористый углерод?
Ответ: Использование тетрахлорметана запрещено во многих странах из-за его токсичности и риска для окружающей среды, поэтому его доступность для покупки ограничена.
Вопрос: Законен ли четыреххлористый углерод?
Ответ: Во многих странах тетрахлорметан подлежит законодательным ограничениям из-за его вредного воздействия на здоровье и окружающую среду.
Вопрос: Четырёххлористый углерод – это щелочь или кислота?
A: Тетрахлорметан не является ни щелочным, ни кислотным; это нейтральное соединение.
Вопрос: Четыреххлористый углерод полярен или неполярен?
Ответ: Тетрахлорметан является неполярной молекулой из-за своей симметричной тетраэдрической структуры, которая приводит к равному распределению электронов.
Вопрос: Какова молярная масса четыреххлористого углерода?
A: Молярная масса тетрахлорметана составляет примерно 153,82 г/моль.
Вопрос: Что такое четыреххлористый углерод?
Ответ: Тетрахлорметан — это бесцветное жидкое соединение, которое раньше использовалось в основном в качестве растворителя, но в настоящее время его использование ограничено из-за его токсичности и экологических проблем.
Вопрос: Какова химическая формула четыреххлористого углерода?
Ответ: Химическая формула тетрахлорметана — CCl4.
Вопрос: Является ли связь четыреххлористым углеродом?
A: Связь в тетрахлорметане ковалентная, с четырьмя ковалентными связями между центральным атомом углерода и окружающими атомами хлора.
Вопрос: Четырёххлористый углерод ионный или ковалентный?
Ответ: Тетрахлорметан является ковалентным соединением, поскольку он образует связи путем совместного использования электронов между атомами углерода и хлора.
Вопрос: Сколько атомов хлора содержится в молекуле четыреххлористого углерода?
Ответ: В молекуле тетрахлорметана четыре атома хлора.
Вопрос: Для каждого растворенного вещества определите лучший растворитель: воду или четыреххлористый углерод?
Ответ: Выбор лучшего растворителя зависит от растворенного вещества. Вода обычно является лучшим растворителем для полярных веществ, а тетрахлорметан лучше для неполярных веществ.
Вопрос: Структура Льюиса тетрахлорметана?
Ответ: В структуре Льюиса тетрахлорметана центральный атом углерода связан с четырьмя атомами хлора, без неподеленных пар на центральном атоме углерода.
