Хлорид никеля(II), известный как NiCl2, представляет собой химическое соединение зеленовато-желтого цвета. Он обычно используется в гальванотехнике, катализаторах и в качестве прекурсора при синтезе других соединений никеля.
| Название ИЮПАК | Хлорид никеля(II) |
| Молекулярная формула | NiCl2 |
| Количество CAS | 7718-54-9 |
| Синонимы | Хлорид никеля, дихлорид никеля, дихлорникель, хлорид никеля |
| ИнЧИ | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
Свойства хлорида никеля
Формула хлорида никеля
Формула дихлорида никеля — NiCl2. Это указывает на то, что каждая молекула дихлорида никеля состоит из одного атома никеля, связанного с двумя атомами хлора. Эта химическая формула дает важную информацию о составе и соотношении элементов, присутствующих в соединении.
хлорид никеля Молярная масса
Молярная масса дихлорида никеля, рассчитанная путем сложения атомных масс составляющих его элементов, составляет примерно 129,6 грамма на моль. Это значение полезно для определения количества дихлорида никеля, присутствующего в данном образце, а также для различных стехиометрических расчетов.
Температура кипения хлорида никеля
Дихлорид никеля имеет температуру кипения около 1,007 градусов Цельсия (1,845 градусов по Фаренгейту). При этой температуре соединение претерпевает фазовый переход из жидкого состояния в газообразное. Температура кипения — важное физическое свойство, которое помогает понять поведение дихлорида никеля при нагревании.
Температура плавления хлорида никеля
Температура плавления дихлорида никеля составляет примерно 1002 градуса Цельсия (1836 градусов по Фаренгейту). Это температура, при которой твердая форма дихлорида никеля переходит в жидкое состояние. Температура плавления важна для применений, связанных с обращением и переработкой дихлорида никеля.
Плотность хлорида никеля г/мл
Плотность дихлорида никеля составляет примерно 3,55 грамма на миллилитр. Плотность является мерой массы единицы объема вещества и дает информацию о компактности материала. Плотность дихлорида никеля помогает определить его поведение в различных применениях и в разных физических состояниях.
Хлорид никеля Молекулярный вес
Молекулярная масса дихлорида никеля составляет примерно 129,6 грамма на моль. Его рассчитывают путем сложения атомных масс никеля и хлора в соединении. Молекулярный вес важен для понимания взаимосвязи между массой, молями и количеством частиц в химических реакциях.
Структура хлорида никеля
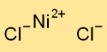
Дихлорид никеля в твердой форме имеет структуру кристаллической решетки. Он состоит из катионов никеля (Ni2+) и хлорид-анионов (Cl-), расположенных поочередно. Такое расположение образует трехмерную сетку, способствующую стабильности и физическим свойствам дихлорида никеля.
Растворимость хлорида никеля
Дихлорид никеля имеет умеренную растворимость в воде. Он может раствориться с образованием зеленовато-желтого раствора. На растворимость дихлорида никеля влияют такие факторы, как температура и присутствие других веществ. Понимание его растворимости важно в различных промышленных процессах и химических применениях, связанных с дихлоридом никеля.
| Появление | Зеленовато-желтое твердое вещество |
| Удельный вес | 3,55 г/мл |
| Цвет | зеленовато-желтый |
| Запах | Без запаха |
| Молярная масса | 129,6 г/моль |
| Плотность | 3,55 г/мл |
| Точка плавления | 1002°С (1836°Ф) |
| Точка кипения | 1007°С (1845°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Умеренный |
| Растворимость | Растворим в органических растворителях (этанол, ацетон) и кислотах. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Кислота (около 4) |
Хлорид никеля: безопасность и опасности
Дихлорид никеля представляет определенные риски для безопасности, которые необходимо учитывать. Важно обращаться с этим соединением осторожно, чтобы избежать потенциальных рисков. Дихлорид никеля может вызвать раздражение и повышенную чувствительность кожи, поэтому при работе с ним следует надевать перчатки и защитную одежду. Следует избегать вдыхания пыли или паров дихлорида никеля, поскольку это может вызвать раздражение дыхательных путей. Проглатывание дихлорида никеля может быть вредным, и его следует избегать. Кроме того, дихлорид никеля токсичен для водной флоры и фауны и может нанести ущерб окружающей среде при попадании в водоемы. Чтобы свести к минимуму риски, связанные с дихлоридом никеля, следует соблюдать надлежащие процедуры хранения, обращения и утилизации.
| Символы опасности | Коррозионные, вредные, опасные для окружающей среды |
| Описание безопасности | – Надевайте перчатки и защитную одежду – Избегайте вдыхания пыли и паров – Не допускайте проглатывания – Храните, обращайтесь и утилизируйте надлежащим образом |
| Идентификаторы Организации Объединенных Наций | ООН3288 |
| код ТН ВЭД | 2827.39.80 |
| Класс опасности | 8 (Коррозионный) |
| Группа упаковки | III |
| Токсичность | Вреден при проглатывании, вызывает раздражение кожи и глаз. |
Методы синтеза хлорида никеля
Существует несколько методов синтеза дихлорида никеля, каждый из которых имеет свои преимущества и области применения.
Обычный метод включает реакцию металлического никеля или оксида никеля с соляной кислотой. В этом процессе металлический никель или оксид никеля добавляют в подходящий контейнер и перемешивают, медленно добавляя соляную кислоту. В результате реакции между никелем и кислотой образуется дихлорид никеля, а также выделяется газообразный водород.
Другой метод синтеза включает реакцию карбоната никеля и соляной кислоты. Соляная кислота растворяет карбонат никеля, и нагретый раствор вступает в реакцию с образованием дихлорида никеля и выделением углекислого газа.
Соляная кислота вступает в реакцию с растворенным гидроксидом никеля при нагревании или оставлении раствора стоять, что приводит к синтезу дихлорида никеля. Реакция приводит к образованию дихлорида никеля и воды.
Кроме того, дихлорид никеля можно получить путем реакции металлического никеля с газообразным хлором. Эта прямая реакция между двумя элементами дает дихлорид никеля.
Эти методы синтеза предлагают различные пути получения дихлорида никеля, что обеспечивает гибкость с точки зрения сырья и условий реакции. Выбор метода зависит от таких факторов, как желаемая чистота конечного продукта, наличие сырья и конкретные требования к применению.
Использование хлорида никеля
Дихлорид никеля имеет различное применение в различных отраслях промышленности благодаря своим уникальным свойствам. Вот некоторые из его заметных применений:
- Гальваника. В процессах гальваники обычно используется дихлорид никеля для создания защитного и декоративного покрытия на различных поверхностях. Дихлорид никеля улучшает внешний вид таких металлов, как сталь, латунь и медь, обеспечивая при этом коррозионную стойкость.
- Катализатор: дихлорид никеля действует как катализатор во многих химических реакциях, включая процессы гидрирования и полимеризации. Он облегчает преобразование реагентов в желаемые продукты и находит применение в производстве фармацевтических препаратов, пластмасс и синтетических волокон.
- Химический синтез: дихлорид никеля служит прекурсором в синтезе различных соединений никеля, таких как оксид никеля, сульфид никеля и цианид никеля. Промышленность использует эти соединения в катализаторах, пигментах, керамике и магнитных материалах.
- Аккумуляторы. В аккумуляторных батареях, особенно никель-металлогидридных (NiMH) батареях, в качестве электролита используется дихлорид никеля. Это обеспечивает циркуляцию ионов между электродами во время циклов зарядки и разрядки.
- Очистка газа. Промышленность использует дихлорид никеля в процессах очистки газа для удаления примесей, таких как сероводород и окись углерода. Он находит применение в переработке природного газа и нефтехимической переработке.
- Кормовая добавка для животных: Корма для скота, особенно для птицы и свиней, содержат дихлорид никеля в качестве пищевой добавки. Он облегчает активность ферментов и способствует общему здоровью и росту животных.
- Лабораторные исследования: исследователи используют дихлорид никеля в различных лабораторных экспериментах, в том числе в реакциях, катализируемых никелем, и в качестве источника ионов никеля для химического анализа.
Эти разнообразные применения демонстрируют универсальность и важность дихлорида никеля в различных секторах: от производства и энергетики до сельского хозяйства и исследований.
Вопросы:
Вопрос: Какие ионы присутствуют в водном растворе NiCl2?
A: В водном растворе NiCl2 присутствуют ионы Ni2+ (катион никеля) и Cl- (хлорид-анион).
Вопрос: Растворим ли NiCl2 в воде?
Ответ: Да, NiCl2 растворим в воде и образует зеленовато-желтый водный раствор.
Вопрос: Какой металл самопроизвольно реагирует с NiCl2(водн.)?
Ответ: Такие металлы, как магний (Mg) и цинк (Zn), самопроизвольно реагируют с NiCl2(водн.), вытесняя никель и образуя соответствующие хлориды.
Вопрос: NiCl2 полярный или неполярный?
Ответ: NiCl2 является полярным соединением из-за разницы в электроотрицательности никеля и хлора, что приводит к неравномерному распределению заряда.
Вопрос: Является ли NiCl2 водным?
Ответ: Да, NiCl2 может существовать в водном состоянии при растворении в воде, образуя водный раствор.
Вопрос: Как называется соединение формулы NiCl2?
Ответ: Соединение формулы NiCl2 называется хлоридом никеля(II).
Вопрос: Как приготовить 1,00 л 0,50 М раствора NiCl2?
Ответ: Чтобы приготовить 0,50 М раствор NiCl2, растворите 129,6 г NiCl2 в воде и доведите объем до 1,00 л.
Вопрос: Какая нерастворимая соль образуется между раствором Na2S и NiCl2?
Ответ: При смешивании раствора Na2S с NiCl2 образуется нерастворимый сульфид никеля (NiS).
Вопрос: Является ли NiCl2(водный) твердым веществом?
Ответ: Нет, NiCl2(водный) относится к водному раствору NiCl2, что указывает на то, что он находится в жидкой форме.
Вопрос: Что делает кристаллический хлорид никеля(II) зеленым?
Ответ: Зеленый цвет кристаллического хлорида никеля(II) обусловлен наличием катионов никеля (Ni2+) в кристаллической решетке.
Вопрос: Является ли дихлорид никеля токсичным?
Ответ: Да, дихлорид никеля токсичен, и с ним следует обращаться с осторожностью. Он может вызвать раздражение кожи и проблемы с дыханием, а также вреден при проглатывании.
Вопрос: Происходит ли реакция при соединении водных растворов NiCl2 и Na2S?
Ответ: Да, при объединении водных растворов NiCl2 и Na2S происходит реакция, в результате которой образуются нерастворимый сульфид никеля (NiS) и растворимый хлорид натрия (NaCl).
Вопрос: Сколько граммов NiCl2 необходимо для нейтрализации 75,0 мл 0,555 М гидроксида лития?
A: Для нейтрализации 75,0 мл 0,555 М гидроксида лития в стехиометрической реакции требуется примерно 18,4 грамма NiCl2.
Вопрос: Что произойдет, если смешать карбонат аммония, дихлорид никеля и воду?
Ответ: При смешивании карбоната аммония, дихлорида никеля и воды происходит реакция, приводящая к образованию хлорида аммония, карбоната никеля и воды.
