Хлорид меди или хлорид меди(I) представляет собой соединение с химической формулой CuCl, состоящее из одного атома меди и одного атома хлора. Это белое твердое вещество с кристаллической структурой, которое используется в различных промышленных целях, например, в качестве катализатора и при производстве других соединений меди.
| Название ИЮПАК | Хлорид меди(I) |
| Молекулярная формула | CuCl |
| Количество CAS | 7758-89-6 |
| Синонимы | Монохлорид меди, хлорид меди (CuCl), хлорид меди(I), хлорид меди, нантокит. |
| ИнЧИ | InChI=1S/ClH.Cu/h1H;/q;+1/p-1 |
Формула хлорида меди(I)
Формула хлорида меди(I) — CuCl. Это указывает на то, что каждая молекула хлорида меди(I) содержит один атом меди и один атом хлора. Формулу можно использовать для расчета массы образца хлорида меди(I) или количества молей хлорида меди(I), присутствующего в образце. Формула также предоставляет информацию об относительном количестве атомов, присутствующих в соединении, что полезно для понимания его свойств и поведения.
Молярная масса of хлорид меди(I)
Молярная масса хлорида меди(I) равна массе одного моля соединения. Его рассчитывают путем сложения атомных масс элементов, входящих в состав соединения. Хлорид меди(I) имеет молярную массу 98,99 г/моль. Это значение можно использовать для преобразования массы образца хлорида меди (I) в количество молей, присутствующих в образце.
Температура кипения хлорида меди(I)
Точка кипения хлорида меди(I) — это температура, при которой соединение переходит из жидкого состояния в газообразное. Хлорид меди(I) имеет относительно низкую температуру кипения — 1490°C. Это связано со слабыми межмолекулярными силами между молекулами хлорида меди(I). При этой температуре молекулы получают достаточно кинетической энергии, чтобы преодолеть силы притяжения, удерживающие их вместе в жидкой форме.
Температура плавления хлорида меди(I)
Температура плавления хлорида меди(I) — это температура, при которой соединение переходит из твердого состояния в жидкость. Хлорид меди(I) имеет относительно высокую температуру плавления — 430°C. Это связано с прочными ионными связями между атомами меди и хлора, входящими в состав соединения. При этой температуре подведенной к соединению тепловой энергии достаточно, чтобы разорвать ионные связи и позволить атомам свободно перемещаться в жидкой форме.
Плотность хлорида меди(I) г/мл
Плотность хлорида меди(I) является мерой его массы в единице объема. Хлорид меди(I) имеет плотность 4,14 г/мл при комнатной температуре. Это значение указывает на то, что хлорид меди(I) является плотным веществом и будет течь в менее плотных жидкостях, чем он есть.
Молекулярный вес хлорида меди(I)
Молекулярная масса хлорида меди(I) представляет собой сумму атомных масс атомов одной молекулы соединения. Хлорид меди(I) имеет молекулярную массу 98,99 г/моль. Это значение можно использовать для преобразования массы образца хлорида меди (I) в количество молекул, присутствующих в образце.
Структура хлорида меди(I)
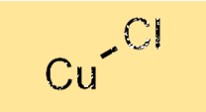
Хлорид меди(I) имеет кристаллическую структуру, в которой атомы меди окружены четырьмя атомами хлора в тетраэдрическом расположении. Атомы меди связаны с атомами хлора ионными связями, которые возникают в результате переноса электронов от атомов меди к атомам хлора. Эта структура придает хлориду меди (I) его характерные свойства, такие как высокая температура плавления и плотность.
| Появление | Белый кристаллический порошок |
| Удельный вес | 4,14 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 98,99 г/моль |
| Плотность | 4,14 г/см³ |
| Точка плавления | 430°С |
| Точка кипения | 1490°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 0,0095 г/л при 20°C |
| Растворимость | Растворим в концентрированной соляной кислоте, аммиаке и цианиде калия. Нерастворим в этаноле и эфире. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | 4,6 – 5,8 (1% раствор) |
Безопасность и опасность хлористой меди
Хлорид меди представляет собой ряд рисков для безопасности и здоровья. Он вреден при проглатывании и может вызвать раздражение глаз, кожи и дыхательной системы. Хлорид меди также может вызывать металлическую лихорадку — состояние, характеризующееся гриппоподобными симптомами, такими как лихорадка, озноб и кашель. Длительное воздействие хлорида меди может вызвать повреждение легких и другие хронические последствия для здоровья. При работе с хлоридом меди важно носить защитную одежду, перчатки и средства защиты глаз, чтобы свести к минимуму риск воздействия. В случае проглатывания или случайного воздействия немедленно обратитесь за медицинской помощью. Правильное обращение, хранение и утилизация хлорида меди необходимы для предотвращения загрязнения окружающей среды и нанесения вреда здоровью человека.
| Символы опасности | Череп и кости |
| Описание безопасности | Не глотать. Надевайте защитную одежду, перчатки и средства защиты глаз. В случае проглатывания или воздействия немедленно обратитесь за медицинской помощью. Требуется правильное обращение, хранение и утилизация. |
| Идентификационные номера ООН | ООН 3077 |
| код ТН ВЭД | 28273910 |
| Класс опасности | 6.1 |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании. Вызывает раздражение кожи и глаз. Может вызвать повреждение легких и другие хронические последствия для здоровья. |
Методы синтеза хлорида меди
Существует несколько методов синтеза хлорида меди:
Распространенный метод включает реакцию между медью и соляной кислотой. Металлическая медь реагирует с соляной кислотой с образованием CuCl и газообразного водорода. CuCl можно очистить фильтрованием и сушкой.
Другой метод включает реакцию между оксидом меди и соляной кислотой.
Для синтеза хлорида меди к раствору соляной кислоты можно добавить оксид меди и получить CuCl2. После этого можно использовать восстановитель, такой как соляная кислота или диоксид серы, чтобы восстановить CuCl2 до CuCl.
Другой метод синтеза CuCl включает растворение сульфата меди и хлорида натрия в воде, нагревание полученного раствора и фильтрацию его для удаления примесей. После фильтрации полученного раствора его можно охладить до образования кристаллов CuCl.
Вариант этого метода включает реакцию между сульфатом меди и хлоридом натрия в присутствии восстановителей, таких как аскорбиновая кислота или глюкоза. Восстановитель восстанавливает ионы Cu2+ в сульфате меди до ионов Cu+, которые затем реагируют с ионами хлорида в хлориде натрия с образованием CuCl.
В целом эти методы предлагают ряд вариантов синтеза хлорида меди с вариациями в зависимости от используемого сырья и условий. При синтезе и обращении с хлоридом меди необходимо уделять пристальное внимание вопросам безопасности и охраны окружающей среды.
Использование хлорида меди
Хлорид меди имеет несколько применений в различных областях. Вот некоторые распространенные способы применения хлорида меди:
- Катализ: используется в качестве катализатора в различных химических реакциях, включая синтез органических соединений, таких как фармацевтические препараты и агрохимикаты.
- Пигмент: используется в качестве пигмента в керамической и стекольной промышленности. Придает зеленый цвет продуктам.
- Средство против обрастания: используется в качестве средства против обрастания в морских целях для предотвращения роста ракушек, водорослей и других морских организмов на кораблях и лодках.
- Фотография: используется в качестве фотопроявителя для создания черно-белых изображений. Он используется в качестве восстановителя для преобразования ионов серебра в металлическое серебро.
- Гальваника: используется в гальванике для нанесения слоя меди на подложку. Его используют при производстве электронных компонентов, ювелирных изделий и другой продукции.
- Фунгицид: используется в качестве фунгицида для защиты растений от грибковых заболеваний.
- Пайка: используется при сварке для удаления оксидных слоев с металлических поверхностей перед сваркой.
- Травление: используется в качестве травителя при производстве печатных плат и других электронных компонентов.
Хлорид меди широко применяется в различных отраслях промышленности благодаря своим отличительным свойствам. Промышленность использует его в различных областях: от катализа до морских покрытий.
Вопросы:
Вопрос: Растворим ли CuCl в воде?
Ответ: Да, CuCl слабо растворим в воде, его растворимость составляет примерно 0,67 г/л при комнатной температуре.
Вопрос: Растворим ли CuCl?
Ответ: CuCl слабо растворим в воде, но нерастворим в органических растворителях, таких как этанол и эфир.
Вопрос: Как называется CuCl?
A: Название CuCl — хлорид меди.
Вопрос: Что вызывает появление пузырьков при помещении алюминия в раствор CuCl? Ответ: Когда алюминий помещается в раствор CuCl, происходит окислительно-восстановительная реакция, при которой алюминий восстанавливает ионы Cu2+ в CuCl до ионов Cu+, образуя хлорид алюминия (AlCl3) и металлическую медь (Cu). Наблюдаемые пузырьки представляют собой газообразный водород (H2), образующийся как побочный продукт реакции между молекулами алюминия и воды, присутствующими в растворе.
