Фторид натрия (NaF) — химическое соединение, используемое для предотвращения кариеса. Он укрепляет зубную эмаль путем ее реминерализации и подавляет рост вредных бактерий полости рта.
| Название ИЮПАК | Фторид натрия |
| Молекулярная формула | НаФ |
| Количество CAS | 7681-49-4 |
| Синонимы | монофторид натрия, безводный фторид натрия, фторид натрия, фторид натрия, |
| Solutia SFL, Fluka 01178, 3M ESPE 12104, Puriss. фторид натрия, особо чистый фторид натрия | |
| ИнЧИ | ИнХI=1S/FH.Na/h1H;/q;+1/p-1 |
Свойства фторида натрия
Формула фторида натрия
Химическая формула фторида натрия — NaF. Это означает, что каждая молекула NaF состоит из одного иона Na+ и одного иона F-. Формула важна в химии, поскольку дает информацию о типах и количестве атомов или ионов в молекуле вещества.
фторид натрия Молярная масса
Молярная масса NaF составляет 41,99 г/моль. Он представляет собой сумму атомных масс атома натрия и атома фтора, которые составляют 22,99 г/моль и 19,00 г/моль соответственно. Молярная масса — важное свойство в химии, поскольку позволяет рассчитать количество молей вещества по его массе, и наоборот.
Температура кипения фторида натрия
Температура кипения NaF составляет 1705°C (3101°F). Это температура, при которой жидкая форма NaF переходит в газовую форму. NaF имеет относительно высокую температуру кипения по сравнению с другими соединениями F из-за сильной ионной связи между ионами Na+ и ионами F-.
Температура плавления фторида натрия
Температура плавления NaF составляет 993°C (1819°F). Это температура, при которой твердая форма NaF переходит в жидкую форму. NaF имеет относительно высокую температуру плавления из-за сильной ионной связи между ионами Na+ и ионами F-.
Плотность фторида натрия г/мл
Плотность NaF составляет 2,79 г/мл. Это означает, что один миллилитр NaF весит 2,79 грамма. Плотность является важным свойством вещества, поскольку ее можно использовать для определения массы вещества по его объему или объема вещества по его массе.
Молекулярный вес фторида натрия
Молекулярная масса NaF составляет 41,99 г/моль. Это сумма атомных масс натрия и фтора в молекуле NaF. Молекулярный вес важен в химии, поскольку он помогает рассчитать различные свойства вещества, такие как его плотность и молярность.
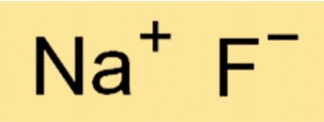
Структура фторида натрия
NaF имеет кристаллическую структуру в твердой форме. Он состоит из ионов Na+ и ионов F-, расположенных в виде кубической решетки. Ионы Na+ занимают углы куба, а ионы фтора — центры граней куба. Такое расположение приводит к прочной ионной связи между ионами Na+ и ионами F-.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,79 г/см³ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 41,99 г/моль |
| Плотность | 2,79 г/мл |
| Точка плавления | 993°С (1819°Ф) |
| Точка кипения | 1705°С (3101°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 4,24 г/100 мл (20°С) |
| Растворимость | Растворим в спирте и эфире |
| Давление газа | 1 мм рт.ст. (713°С) |
| Плотность пара | 2,9 (воздух = 1) |
| пКа | 7.2 |
| рН | 7,6-8,4 (0,1 М водный раствор) |
Безопасность и опасность фторида натрия
У NaF есть некоторые проблемы с безопасностью и опасностью. Он токсичен при приеме внутрь в больших количествах и может вызвать тошноту, рвоту, диарею и боли в животе. Вдыхание пыли NaF может вызвать раздражение дыхательных путей и повреждение легких. При контакте он также может вызвать раздражение глаз и кожи. NaF также вызывает коррозию некоторых металлов и может бурно реагировать с сильными кислотами. Чтобы избежать этих опасностей, при работе с NaF следует соблюдать надлежащие процедуры обращения, хранения и утилизации. При работе с NaF важно всегда носить соответствующие средства индивидуальной защиты.
| Символы опасности | Т, Н |
| Описание безопасности | Избегать проглатывания, вдыхания, попадания на кожу и в глаза. Носите соответствующие средства индивидуальной защиты. Соблюдайте процедуры безопасного обращения, хранения и утилизации. |
| Идентификационные номера ООН | UN1690 (для твердых веществ) |
| код ТН ВЭД | 2826.12.00 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании в больших количествах. Может вызвать раздражение дыхательных путей, глаз и кожи. Коррозионно для некоторых металлов. |
Методы синтеза фторида натрия
Химики используют несколько методов для синтеза фторида натрия (NaF).
Распространенным методом является взаимодействие плавиковой кислоты с гидроксидом натрия или карбонатом натрия . Чтобы удалить воду и примеси, полученный продукт сушат и нагревают.
Другой метод включает реакцию NaCl с HF , в результате которой в качестве побочных продуктов образуются NaF и хлористый водород. Этот метод менее распространен из-за проблем безопасности, связанных с обращением с фтористым водородом.
Другой способ синтеза NaF — взаимодействие карбоната натрия с газообразным HF . В результате реакции образуется NaF, углекислый газ и водяной пар. В промышленности этот метод обычно используется для производства NaF.
Кроме того, NaF можно синтезировать путем нагревания газообразного фтора с металлическим натрием. Однако этот метод встречается редко из-за высокой реакционной способности натрия и фтора. Кроме того, этот метод требует специального оборудования и осторожного обращения из-за риска взрыва.
Использование фторида натрия
NaF имеет несколько применений в разных секторах. Вот некоторые распространенные варианты использования NaF:
- Гигиена полости рта: зубные пасты, жидкости для полоскания рта и средства для ухода за зубами добавляют NaF для предотвращения кариеса и улучшения здоровья полости рта.
- Очистка воды: в некоторых регионах добавляется в питьевую воду для предотвращения кариеса.
- Промышленное применение: используется в качестве флюса при производстве алюминия, стекла и керамики для снижения температуры плавления и улучшения прозрачности.
- Металлургия: используется при рафинировании и обработке металлов, например, для удаления примесей при производстве стали и алюминия.
- Пестицид: используется в качестве пестицида для борьбы с грызунами и насекомыми.
- Химия: Используется в качестве источника ионов фтора в различных химических реакциях.
- Атомная промышленность: используется в качестве теплоносителя и теплоносителя в некоторых ядерных реакторах.
- Фармацевтические препараты: используются при производстве некоторых лекарств, таких как антидепрессанты и противовоспалительные средства.
Вопросы:
Вопрос: Вреден ли фторид натрия в зубной пасте для вашего здоровья?
Ответ: NaF, содержащийся в зубной пасте, обычно считается безопасным при использовании по назначению. Он помогает предотвратить разрушение зубов и одобрен стоматологическими ассоциациями по всему миру. Однако чрезмерное употребление зубной пасты может привести к расстройству желудка и другим проблемам со здоровьем.
Вопрос: Будет ли разбавленный или концентрированный раствор фторида натрия иметь более высокую температуру кипения?
Ответ: Концентрированный раствор NaF будет иметь более высокую температуру кипения, чем разбавленный раствор, из-за увеличенного количества частиц растворенного вещества в растворе, что увеличивает температуру кипения за счет эффекта повышения точки кипения.
Вопрос: Сколько граммов содержится в 4,5 молях фторида натрия?
Ответ: Молярная масса NaF равна 41,99 г/моль, поэтому 4,5 моля NaF будут составлять 188,96 грамма.
Вопрос: Является ли фторид натрия ионным или ковалентным?
Ответ: NaF представляет собой ионное соединение, образующееся в результате электростатического притяжения между ионами Na+ и ионами F-.
Вопрос: Как правильно представить ионное соединение фторид натрия?
Ответ: Правильным способом обозначения этого ионного соединения является NaF, где Na представляет собой Na+, а F представляет собой F-.
Вопрос: Как называется соединение с формулой NaF?
A: Название соединения формулы NaF — фторид натрия.
Вопрос: NaF – это кислота или основание?
Ответ: NaF представляет собой соль, образующуюся в результате реакции нейтрализации между сильным основанием (гидроксидом натрия) и слабой кислотой (фтороводородной кислотой). Это не кислота и не основание, но он может подвергаться гидролизу с образованием основного раствора.
