Фосфат кальция (Ca3(PO4)2) — минерал, содержащийся в зубах и костях. Это помогает сделать их сильными и здоровыми. Его также используют в качестве пищевой добавки для предотвращения дефицита кальция.
| Название ИЮПАК | Фосфат кальция |
| Молекулярная формула | Са3(PO4)2 |
| Количество CAS | 7758-87-4 |
| Синонимы | Трикальцийфосфат, костный фосфат, ортофосфат кальция, трехосновный фосфат кальция, TCP |
| ИнЧИ | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Свойства фосфата кальция
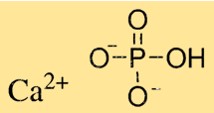
Формула фосфата кальция
Химическая формула фосфата кальция — Ca3(PO4)2, что указывает на то, что он содержит три иона кальция и два иона фосфата. Формула используется для расчета количества фосфата кальция, необходимого для химических реакций. Фосфат кальция является важным компонентом зубов и костей, а также используется в различных отраслях промышленности, например, в качестве пищевых добавок и удобрений.
Молярная масса фосфата кальция
Молярная масса Ca3(PO4)2 составляет 310,18 г/моль. Его рассчитывают путем сложения атомных масс кальция, фосфора и кислорода, которые составляют 40,08 г/моль, 30,97 г/моль и 15,99 г/моль соответственно. Молярная масса является важным параметром при определении количества Ca3(PO4)2, необходимого для химической реакции.
Температура кипения фосфата кальция
Ca3(PO4)2 не имеет определенной температуры кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании Ca3(PO4)2 разлагается на оксид кальция и пятиокись фосфора с выделением водяного пара. Температура разложения зависит от типа Ca3(PO4)2 и скорости нагрева.
Температура плавления фосфата кальция
Температура плавления Ca3(PO4)2 зависит от типа Ca3(PO4)2. Температура плавления трикальцийфосфата, наиболее распространенной в природе формы Ca3(PO4)2, составляет около 1670°С. Дикальцийфосфат имеет температуру плавления около 1400°C, а монокальцийфосфат плавится при температуре около 109°C.
Плотность фосфата кальция г/мл
Плотность Ca3(PO4)2 варьируется в зависимости от типа Ca3(PO4)2. Трикальцийфосфат имеет плотность примерно 3,14 г/мл, а дикальцийфосфат имеет плотность примерно 2,31 г/мл. Монокальцийфосфат имеет плотность примерно 2,22 г/мл.
Молекулярный вес фосфата кальция
Молекулярная масса Ca3(PO4)2 составляет 310,18 г/моль, что соответствует сумме атомных масс кальция, фосфора и кислорода. Молекулярная масса важна для расчета количества Ca3(PO4)2, необходимого для химических реакций.
Структура фосфата кальция
Ca3(PO4)2 имеет сложную кристаллическую структуру, которая зависит от типа Ca3(PO4)2. Трикальцийфосфат имеет гексагональную кристаллическую структуру, а дикальцийфосфат имеет моноклинную кристаллическую структуру. Монокальцийфосфат имеет тетрагональную кристаллическую структуру. Кристаллы Ca3(PO4)2 состоят из ионов кальция и ионов фосфата, расположенных определенным образом.
| Появление | Белый порошок или кристаллы |
| Удельный вес | 3.14 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 310,18 г/моль |
| Плотность | 3,14 г/мл (трикальцийфосфат) |
| Точка плавления | 1670 °C (трикальцийфосфат) |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Н/Д |
| Растворимость в воде | 0,002 г/100 мл (при 25°С) |
| Растворимость | Растворим в кислотах, нерастворим в воде |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | рКа1: 1,9, рКа2: 6,7, рКа3: 12,0 |
| рН | 5,5-7,5 (10% суспензия в воде) |
Безопасность и опасность фосфата кальция
Ca3(PO4)2 обычно считается безопасным для потребления человеком и не представляет существенного риска для здоровья. Это природный минерал, содержащийся в костях и зубах и используемый во многих формах в качестве пищевой добавки. Ca3(PO4)2 также используется в пищевой промышленности в качестве пищевой добавки и кондиционера для теста. Однако чрезмерное потребление добавок Ca3(PO4)2 может привести к побочным эффектам, таким как расстройство желудка, запор и даже повреждение почек. Кроме того, воздействие высоких концентраций пыли Ca3(PO4)2 на рабочем месте может вызвать проблемы с дыханием. Поэтому важно использовать добавки и продукты Ca3(PO4)2 в умеренных количествах и соблюдать правила промышленной безопасности.
| Символы опасности | Никто не известен |
| Описание безопасности | 26-36/37/39: Носите соответствующую защитную одежду, перчатки и средства защиты глаз/лица. |
| Идентификационные номера ООН | Н/Д |
| код ТН ВЭД | 28352500 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность |
Методы синтеза фосфата кальция
Существует несколько методов синтеза Ca3(PO4)2, включая осаждение, гидротермальный синтез, золь-гель-процесс и твердофазную реакцию.
Метод осаждения включает объединение ионов кальция и фосфата в водном растворе, в результате чего в результате химической реакции образуется осадок. Затем экспериментатор промывает и сушит осадок, получая искомое соединение Ca3(PO4)2.
Гидротермальный синтез включает реакцию источников кальция и фосфата в среде высокого давления и высокой температуры. Для получения желаемого соединения Ca3(PO4)2 полученный продукт промывают и сушат.
В золь-гель-процессе золь или коллоидная суспензия преобразуется в гель, а затем высушивается с получением желаемого соединения Ca3(PO4)2. Этот метод позволяет точно контролировать состав и морфологию получаемого соединения.
Твердотельная реакция включает смешивание пирофосфата кальция и карбоната кальция в твердом состоянии, а затем нагревание смеси для стимулирования химической реакции. Для получения искомого соединения Ca3(PO4)2 полученный продукт необходимо промыть и высушить.
Использование фосфата кальция
Ca3(PO4)2 имеет множество применений в различных отраслях промышленности благодаря своим уникальным свойствам. Некоторые из распространенных применений Ca3(PO4)2:
- Пищевые добавки: обычно используются в пищевых добавках в качестве источника кальция и фосфора, которые являются важными минералами для здоровья костей.
- Пищевая промышленность и производство напитков: используется в качестве пищевой добавки во многих обработанных пищевых продуктах, включая хлебобулочные изделия, молочные продукты и напитки. В выпечке люди используют его как уходовое средство и источник кальция.
- Фармацевтическая промышленность: используется в фармацевтической промышленности в качестве наполнителя и связующего вещества в таблетках и капсулах. Биодоступность некоторых лекарств можно улучшить, если использовать их в качестве покрывающего агента.
- Сельское хозяйство: используется в качестве удобрения для обеспечения растений необходимыми питательными веществами, такими как кальций и фосфор.
- Стоматология: используется в стоматологии для реминерализации зубов и восстановления зубной эмали.
- Биомедицинская инженерия: также используется в биомедицинской инженерии для разработки заменителей костного трансплантата и улучшения свойств биоматериалов, используемых в инженерии костной ткани.
Вопросы:
Вопрос: Почему добавление кислоты увеличивает растворимость фосфата кальция?
Ответ: Добавление кислоты увеличивает растворимость Ca3(PO4)2 за счет протонирования ионов фосфата, что делает их более растворимыми в воде. Протонированные ионы фосфата образуют кислую форму Ca3(PO4)2, которая более растворима, чем нейтральная форма.
Вопрос: Сколько граммов фосфора содержится в 500,0 граммах фосфата кальция?
A: Молярная масса Ca3(PO4)2 составляет 310,18 г/моль. Соединение имеет соотношение фосфор/кальций 2:3, поэтому молярная масса фосфора составляет 30,97 г/моль. Следовательно, в 500,0 граммах Ca3(PO4)2 содержится 81,62 грамма фосфора.
Вопрос: Растворим ли фосфат кальция?
A: Ca3(PO4)2 имеет низкую растворимость в воде, растворимость продукта составляет 1,8 x 10^-29. Однако его растворимость можно повысить добавлением кислот.
Вопрос: Какова массовая доля кислорода в фосфате кальция?
A: Молярная масса Ca3(PO4)2 составляет 310,18 г/моль. Атомная масса кислорода составляет 16,00 г/моль, в одном моле Ca3(PO4)2 содержится 8 атомов кислорода. Следовательно, масса кислорода в одном моле Са3(РО4)2 равна 8 х 16,00 = 128,00 г. Масса Ca3(PO4)2 составляет 310,18 г, поэтому процентное содержание кислорода по массе составляет (128,00 г / 310,18 г) x 100% = 41,23%.
Вопрос: Растворим ли Ca3(PO4)2 в воде?
A: Ca3(PO4)2 плохо растворим в воде, растворимость продукта составляет 1,3 x 10^-33.
Вопрос: Какова молярная масса Ca3(PO4)2?
A: Молярная масса Ca3(PO4)2 составляет 310,18 г/моль.
Вопрос: Что такое Ca3(PO4)2?
Ответ: Ca3(PO4)2 представляет собой химическое соединение, состоящее из трех ионов Ca2+ и двух ионов PO43-. Это белый порошок без запаха, нерастворимый в воде.
Вопрос: Какова формула массы Ca3(PO4)2 в граммах?
A: Формульная масса Ca3(PO4)2 в граммах равна 310,18 г/моль.
