Фосфат калия (K3PO4) – это соединение, содержащее элементы калий и фосфор. Его широко используют в качестве пищевой добавки и удобрения из-за его высокой растворимости и способности обеспечивать необходимые питательные вещества для роста растений.
| Название ИЮПАК | Фосфат калия |
| Молекулярная формула | К3ПО4 |
| Количество CAS | 7778-53-2 |
| Синонимы | Трикалия фосфат, ортофосфат калия, третичный фосфат калия, трикалия монофосфат, трехосновный фосфат калия |
| ИнЧИ | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Свойства фосфата калия
Формула фосфата калия
Химическая формула фосфата калия – K3PO4. Это указывает на то, что в каждой формульной единице соединения присутствуют три иона К+ и один ион РО43-. Формула фосфата калия полезна для определения стехиометрии реакций с участием соединения, а также для определения количества каждого элемента, присутствующего в заданной массе соединения.
Молярная масса фосфата калия
Молярная масса K3PO4 составляет 212,27 г/моль. Его рассчитывают путем прибавления к соединению атомных масс калия, фосфора и кислорода. Молярная масса является важным параметром для определения количества вещества, присутствующего в данной массе соединения. Это также полезно для расчета стехиометрии реакций с участием K3PO4.
Температура кипения фосфата калия
Температура кипения K3PO4 составляет 1660°С. Такая высокая температура кипения обусловлена прочными ионными связями между ионами K+ и ионами PO43- в соединении. Это также является показателем стабильности соединения при высоких температурах. Точка кипения K3PO4 полезна в различных отраслях промышленности, например, при производстве керамики и стекла.
Температура плавления фосфата калия
Температура плавления K3PO4 составляет 1340°С. Это температура, при которой твердое соединение переходит в жидкое состояние. Высокая температура плавления K3PO4 обусловлена ионной природой соединения, требующей большого количества энергии для преодоления сил притяжения между ионами. Точка плавления K3PO4 полезна при определении его пригодности для различных применений, таких как производство удобрений и пищевых добавок.
Плотность фосфата калия г/мл
Плотность K3PO4 составляет 2,564 г/мл при комнатной температуре. Высокая плотность соединения обусловлена наличием в каждой формульной единице трех ионов К+ и одного иона РО43-. Плотность K3PO4 полезна для определения его растворимости и поведения в различных промышленных процессах, например, при производстве удобрений и пищевых добавок.
Молекулярный вес фосфата калия
Молекулярная масса K3PO4 составляет 212,27 г/моль. Это сумма атомных весов всех атомов соединения. Молекулярная масса полезна для расчета количества вещества, присутствующего в заданной массе соединения, а также для определения стехиометрии реакций с участием K3PO4.
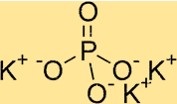
Структура фосфата калия
K3PO4 имеет орторомбическую кристаллическую структуру. Он состоит из набора тетраэдров PO4, в которых каждый фосфатный ион разделяет два атома кислорода с соседними фосфатными ионами. Ионы калия располагаются между фосфатными тетраэдрами, окруженными атомами кислорода. Структура K3PO4 полезна для понимания его свойств, таких как растворимость и термическая стабильность.
| Появление | Белый кристаллический порошок |
| Удельная плотность | 2564 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 212,27 г/моль |
| Плотность | 2564 г/мл |
| Точка плавления | 1340°С |
| Точка кипения | 1660°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 100 г/л (20°С) |
| Растворимость | Растворим в этаноле и ацетоне, нерастворим в эфире. |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | рКа1 = 2,16, рКа2 = 7,21, рКа3 = 12,32 |
| рН | pH 1% раствора составляет 11,5. |
Безопасность и опасности фосфата калия
K3PO4 обычно считается безопасным для использования при правильном обращении. Однако, как и любое химическое вещество, оно может представлять опасность при неправильном обращении или проглатывании в больших количествах. Соединение классифицируется как раздражитель кожи, глаз и дыхательных путей и может вызвать серьезные ожоги или расстройство дыхания при вдыхании или проглатывании в высоких концентрациях. Он также несовместим с кислотами и окислителями и может вызвать пожар или взрыв при контакте с этими материалами. Поэтому важно обращаться с K3PO4 с осторожностью, носить соответствующие защитные средства и хранить его в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых веществ.
| Символы опасности | Си (раздражает) |
| Описание безопасности | Избегайте контакта с кожей и глазами. |
| Идентификационные номера ООН | ООН 2833 (для безводного), ООН 2423 (для тригидрата) |
| код ТН ВЭД | 28352400 |
| Класс опасности | 6.1 (токсичный) |
| Группа упаковки | III |
| Токсичность | LD50 (перорально, крыса): 2340 мг/кг; LC50 (ингаляционно, крыса): 50 мг/л |
Методы синтеза фосфата калия (К3РО4)
Существует несколько методов синтеза K3PO4, включая реакцию фосфорной кислоты (H3PO4) с гидроксидом калия (KOH) или термическое разложение KH2PO4.
Один метод включает взаимодействие эквимолярных количеств КОН и H3PO4 в воде при температуре примерно от 60 до 80°C. Процедура включает упаривание полученной смеси и нагревание твердого остатка примерно до 300°С с получением K3PO4.
Другой метод заключается в реакции KH2PO4 с KOH при высокой температуре (выше 400°C) с образованием K3PO4 и воды. Специализированная печь может осуществлять этот процесс, называемый термическим разложением.
Дополнительными методами получения K3PO4 являются реакция фосфорной кислоты с карбонатом калия (K2CO3) и реакция оксида калия (K2O) с пятиокисью фосфора (P2O5).
Использование фосфата калия
K3PO4 имеет несколько практических применений в различных отраслях промышленности, в том числе:
- Удобрение: обычно используется в качестве удобрения из-за высокого содержания фосфора. Фермеры часто добавляют его в почву, чтобы обеспечить растения необходимыми питательными веществами.
- Пищевая промышленность: используется в качестве пищевой добавки для регулирования уровня кислотности, предотвращения изменения цвета и улучшения текстуры.
- Буферный агент: в различных лабораторных применениях он используется в качестве эффективного буферного агента, включая буферные растворы для калибровки pH и биологические исследования.
- Моющие средства: используются в производстве моющих и чистящих средств благодаря своей способности смягчать воду и предотвращать накопление минеральных отложений.
- Лекарство: используется в качестве пищевой добавки для лечения определенных заболеваний, таких как низкий уровень фосфатов в крови.
- Водоочистка: используется при очистке воды для предотвращения образования накипи и коррозии в трубах и оборудовании.
- Огнезащитный состав: используется в качестве антипирена в различных материалах, включая текстиль и пластмассы, благодаря своей способности выделять водяной пар и предотвращать распространение огня.
Вопросы:
Вопрос: Растворяется ли фосфат калия в воде?
Ответ: Да, K3PO4 растворим в воде.
Вопрос: Сколько ионов калия необходимо для связывания иона фосфата?
Ответ: Для связывания иона фосфата с образованием K3PO4 необходимы три иона калия.
Вопрос: Какой осадок образуется при смешивании водных растворов бромида кальция и фосфата калия?
Ответ: При смешивании водных растворов бромида кальция и K3PO4 образуется осадок фосфата кальция (Ca3(PO4)2).
Вопрос: Растворим ли k3po4 в воде?
Ответ: Да, K3PO4 растворим в воде.
Вопрос: Растворим ли k3po4?
Ответ: Да, K3PO4 растворим в воде.
Вопрос: Какие продукты образуются при смешивании водных растворов Ni(C2H3O2)2 (водный) и K3PO4 (водный)?
А: При смешивании водных растворов Ni(C2H3O2)2 и K3PO4 образуется осадок фосфата никеля(II) (Ni3(PO4)2), а также водные растворы ацетата калия (KCH3COO) и уксусной кислоты (CH3COOH).
Вопрос: Какой элемент увеличивает свою степень окисления в этой реакции? 3KOH + H3PO4 → K3PO4 + 3H2O
Ответ: Элемент фосфор увеличивает степень окисления с +5 в H3PO4 до +5 в K3PO4.
Вопрос: Что такое K3PO4?
Ответ: K3PO4 — это химическая формула фосфата калия, соединения, используемого в различных областях, таких как удобрения, пищевые добавки и чистящие средства.
