Трихлорид фосфора представляет собой химическое соединение, состоящее из фосфора и трех атомов хлора. Он обычно используется в качестве реагента в химических реакциях и в качестве предшественника фосфорорганических соединений.
| Название ИЮПАК | трихлорид фосфора |
| Молекулярная формула | PCl3 |
| Количество CAS | 7719-12-2 |
| Синонимы | Трихлорфосфин, хлорид фосфора, трихлорид фосфора, хлорид фосфора (III) |
| ИнЧИ | ИнХИ=1S/Cl3P/c1-4(2)3 |
Свойства трихлорида фосфора
Формула трихлорида фосфора
Формула трихлорида фосфора PCl3. Он состоит из одного атома фосфора, связанного с тремя атомами хлора. Это химическое соединение широко используется в различных отраслях промышленности и лабораториях благодаря своей реакционной способности и универсальности.
Молярная масса трихлорида фосфора
Молярную массу трихлорфосфина можно рассчитать путем сложения атомных масс составляющих его элементов. Атомная масса фосфора составляет примерно 31,0 грамма на моль, а атомная масса хлора составляет примерно 35,5 грамма на моль. Следовательно, молярная масса PCl3 составляет примерно 137,3 грамма на моль.
Температура кипения трихлорида фосфора
Трихлорфосфин имеет температуру кипения примерно 76,1 градуса Цельсия. Это означает, что при нагревании он переходит из жидкости в газ. Температура кипения является важным свойством, которое следует учитывать при обращении и использовании трихлорфосфина в различных химических реакциях и процессах.
Трихлорид фосфора Температура плавления
Температура плавления трихлорфосфина составляет примерно -112,7 градусов Цельсия. При этой температуре происходит фазовый переход из твердого состояния в жидкость. Температура плавления является важнейшей характеристикой для определения физического состояния трихлорфосфина в различных условиях.
Плотность трихлорида фосфора г/мл
Плотность трихлорфосфина составляет примерно 1,574 грамма на миллилитр. Плотность представляет собой массу вещества на единицу объема и дает представление о компактности и тяжести материала. Плотность трихлорфосфина часто используется в химических расчетах и формулировках.
Молекулярный вес трихлорида фосфора
Молекулярная масса трихлорфосфина, рассчитанная путем сложения атомных масс его составляющих, составляет примерно 137,3 грамма на моль. Молекулярная масса является ценным параметром для определения количества вещества в химических реакциях и формулирования точных измерений.
Структура трихлорида фосфора
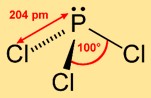
Трихлорфосфин имеет структуру тригональной пирамиды, в которой атом фосфора занимает вершину, а три атома хлора образуют треугольное основание. Такое молекулярное расположение способствует его химической активности и влияет на его поведение в различных реакциях.
Растворимость трихлорида фосфора
Трихлорфосфин плохо растворяется в воде, но легко растворяется в органических растворителях, таких как бензол и четыреххлористый углерод. Свойства растворимости трихлорфосфина являются важным фактором при выборе подходящих растворителей для его использования в различных химических процессах и приложениях.
| Появление | Бесцветная или бледно-желтая жидкость |
| Удельный вес | 1574 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 137,3 г/моль |
| Плотность | 1574 г/мл |
| Точка плавления | -112,7°С |
| Точка кипения | 76,1°С |
| Мигающая точка | Неприменимо (негорючий) |
| Растворимость в воде | Реагирует с водой |
| Растворимость | Растворим в органических растворителях, таких как бензол и четыреххлористый углерод. |
| Давление газа | 105 мм рт.ст. при 25°C |
| Плотность пара | 4,83 (Воздух = 1) |
| пКа | Непригодный |
| рН | Кислота (pH < 7) |
Безопасность и опасность трихлорида фосфора
Трихлорфосфин представляет несколько рисков для безопасности, и с ним следует обращаться с осторожностью. Он очень разъедает кожу, глаза и дыхательную систему. Прямой контакт может вызвать серьезные ожоги и повреждения глаз. Вдыхание его паров может вызвать раздражение дыхательных путей и повреждение легких. Кроме того, трихлорфосфин бурно реагирует с водой, выделяя токсичные пары соляной кислоты. При определенных условиях он легко воспламеняется, а контакт с окислителями может привести к пожару или взрыву. При работе с этим химическим веществом следует использовать соответствующие средства индивидуальной защиты, такие как перчатки, очки и респиратор. Для минимизации рисков необходимы адекватная вентиляция и хранение вдали от несовместимых веществ.
| Символы опасности | Коррозионный, Токсичный |
| Описание безопасности | – Вызывает серьезные ожоги кожи и повреждения глаз. – Вреден при проглатывании, вдыхании или всасывании. – Бурно реагирует с водой с выделением токсичных паров. – Воспламеняемость при определенных условиях. |
| Идентификаторы Организации Объединенных Наций | ООН 1809 |
| код ТН ВЭД | 2812.10.00 |
| Класс опасности | 8 (Коррозионный), 6,1 (Токсичный) |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза трихлорида фосфора
Трихлорфосфин синтезируют различными методами. Распространенный подход заключается в нагревании фосфора избытком газообразного хлора, что приводит к образованию трихлорфосфина.
Другой метод включает нагревание пентахлорида фосфора (PCl5) с трихлорфосфином (PCl3) для получения трихлорфосфина.
Реакция между оксидом фосфора (P2O5) и соляной кислотой (HCl) объединяет эти два вещества, обычно с обратным холодильником, чтобы облегчить синтез трихлорфосфина.
Кроме того, нагревание трибромида фосфора (PBr3) с трихлорфосфином приводит к образованию трихлорфосфина.
Важно отметить, что синтез трихлорфосфина необходимо проводить с соблюдением соответствующих мер безопасности, так как он предполагает обращение с химически активными и опасными веществами. Обеспечьте безопасность в процессе синтеза, используя соответствующее защитное оборудование и поддерживая хорошо вентилируемые лабораторные условия.
В целом, эти различные синтетические методы предлагают разные подходы к получению трихлорфосфина, тем самым обеспечивая гибкость его производства для широкого спектра промышленных и исследовательских применений.
Использование трихлорида фосфора
Трихлорфосфин широко используется в нескольких областях благодаря своей универсальной природе и реакционной способности. Вот некоторые ключевые варианты использования:
- Химический реагент: служит важным реагентом в органическом синтезе, особенно при производстве фосфорорганических соединений. Он участвует в таких реакциях, как реакция Вильсмайера-Хаака и реакция Пудовика.
- Катализатор: Трихлорфосфин действует как катализатор в различных химических реакциях, включая синтез фармацевтических препаратов, красителей и пестицидов.
- Источник фосфора: служит источником фосфора при производстве химикатов на основе фосфора, таких как фосфористая кислота и оксихлорид фосфора.
- Огнезащитный состав: производители добавляют в полимеры трихлорфосфин в качестве антипирена, помогая снизить воспламеняемость и повысить пожаробезопасность материалов.
- Химическое промежуточное соединение: различные химические вещества, включая фармацевтические препараты, гербициды, инсектициды и пластификаторы, производятся с использованием трихлорфосфина в качестве важнейшего промежуточного продукта.
- Лабораторный реагент: Лаборатории широко используют трихлорфосфин в качестве универсального реагента для химических реакций, включая образование ацилхлоридов и превращение спиртов в алкилхлориды.
- Очистка воды: сильные окислительные и хлорирующие свойства трихлорфосфина делают его ценным компонентом в процессах очистки воды, эффективно удаляя примеси и загрязнения.
- Фармацевтика: Трихлорфосфин играет роль в синтезе фармацевтических соединений, в том числе лекарств для лечения рака, воспалений и неврологических расстройств.
- Применение в сельском хозяйстве: находит применение в сельском хозяйстве в качестве компонента некоторых пестицидов и гербицидов, тем самым способствуя защите сельскохозяйственных культур и борьбе с сорняками.
- Производство пластмасс. Производители используют трихлорфосфин при производстве пластмасс и полимерные добавки для улучшения свойств материалов и придания им огнестойкости.
Эти различные применения подчеркивают важность трихлорфосфина в различных отраслях промышленности, исследованиях и повседневном применении.
Вопросы:
Вопрос: Трихлорид фосфора является основанием или кислотой?
Ответ: Трихлорфосфин – это кислота.
Вопрос: Сколько атомов хлора содержится в молекуле трихлорида фосфора PCl3?
Ответ: В молекуле трихлорфосфина три атома хлора.
Вопрос: Каков процентный выход реакции, в которой вступает в реакцию 200 г трихлорида фосфора?
Ответ: Процент выхода невозможно определить без информации о количестве полученного продукта.
Вопрос: Сколько молей в 15 граммах трихлорида фосфора?
Ответ: В 15 граммах содержится примерно 0,116 моль трихлорфосфина.
Вопрос: Какая формула представляет бинарное молекулярное соединение трихлорид фосфора?
Ответ: Формула PCl3 означает трихлорфосфин.
Вопрос: Какова формула трихлорида фосфора?
Ответ: Формула трихлорида фосфора — PCl3.
Вопрос: Трихлорид фосфора ионный или ковалентный?
Ответ: Трихлорфосфин является ковалентным соединением.
Вопрос: Сколько атомов хлора содержится в молекуле трихлорида фосфора PCl3?
Ответ: В молекуле трихлорфосфина три атома хлора.
Вопрос: Структура трихлорфосфина по Льюису?
Ответ: В структуре Льюиса трихлорфосфина центральный атом фосфора связан с тремя атомами хлора, а у атома фосфора есть неподеленные пары.
Вопрос: Фосфор (P4) (т) + Хлор (г) → Трихлорфосфин (л)?
A: Сбалансированное уравнение представляет собой реакцию между твердым фосфором (P4) и газообразным хлором (Cl2) с образованием жидкого PCl3.
Вопрос: Какова форма трихлорида фосфора?
Ответ: Трихлорфосфин имеет форму тригональной пирамиды из-за наличия пары свободных электронов на атоме фосфора.
Вопрос: Является ли трихлорид фосфора ионным соединением?
Ответ: Нет, трихлорфосфин не является ионным соединением; это ковалентное соединение.
Вопрос: Имеет ли трихлорид фосфора плоскости отражения?
Ответ: Нет, у трихлорфосфина нет плоскостей отражения.
