Трихлорид бора (BCl3) представляет собой соединение, состоящее из трех атомов хлора, связанных с одним атомом бора. Он используется в различных промышленных процессах, например, в качестве катализаторов и в качестве реагента в органическом синтезе.
| Название ИЮПАК | Трихлорид бора |
| Молекулярная формула | BCl3 |
| Количество CAS | 10294-34-5 |
| Синонимы | трихлорборан; Хлорид бора(III), трихлорборан, трихлорбор |
| ИнЧИ | ИнЧИ=1S/BCl3/c2-1(3)4 |
Свойства трихлорида бора
Формула трихлорида бора
Формула хлорида бора — BCl3, что означает, что один атом бора связан с тремя атомами хлора. Это простая и понятная молекулярная формула, описывающая состав этого соединения.
трихлорид бора Молярная масса
Молярную массу хлорида бора можно рассчитать путем сложения атомных масс составляющих его элементов. Атомная масса бора составляет примерно 10,81 грамма на моль, а атомная масса каждого атома хлора составляет примерно 35,45 грамма на моль. Следовательно, молярная масса BCl3 составляет примерно 117,17 грамм на моль.
Температура кипения трихлорида бора
Хлорид бора имеет относительно низкую температуру кипения по сравнению со многими другими соединениями. Он кипит при температуре около -15,7 градусов по Цельсию или 3,77 градусов по Фаренгейту. Это означает, что при температуре выше этой точки хлорид бора переходит из жидкой фазы в газовую.
Трихлорид бора Температура плавления
Температура плавления хлорида бора относительно низкая. Он плавится при температуре около -107,5 градусов по Цельсию или -161,5 градусов по Фаренгейту. При температурах ниже этой точки соединение переходит из твердого состояния в жидкое.
Плотность трихлорида бора г/мл
Плотность хлорида бора составляет примерно 1,38 грамма на миллилитр. Это значение указывает массу соединения на единицу объема. Это полезно для определения поведения хлорида бора в различных приложениях и понимания его физических свойств.
Трихлорид бора Молекулярный вес
Молекулярная масса хлорида бора составляет примерно 117,17 грамм на моль. Это значение представляет собой сумму атомных масс всех атомов в молекуле соединения и полезно для различных расчетов, таких как определение количества хлорида бора в данном образце.
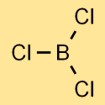
Структура трихлорида бора
Хлорид бора имеет тригональную плоскую молекулярную структуру. Он состоит из атома бора в центре, связанного с тремя атомами хлора, расположенными в треугольной форме. Эта структура влияет на физические и химические свойства соединения.
Растворимость трихлорида бора
Хлорид бора плохо растворяется в воде. Он плохо растворим, то есть растворяется в водных растворах лишь в ограниченной степени. Однако он более растворим в органических растворителях, таких как бензол и четыреххлористый углерод. Растворимость хлорида бора влияет на его поведение в различных химических реакциях и промышленных процессах.
| Появление | Бесцветный газ |
| Удельный вес | 1369 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 117,17 г/моль |
| Плотность | 1,38 г/мл |
| Точка плавления | -107,5°С |
| Точка кипения | -15,7°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует |
| Растворимость | Растворим в органических растворителях, таких как бензол и четыреххлористый углерод. |
| Давление газа | 623 мм рт.ст. при 20°C |
| Плотность пара | 3,24 (воздух = 1) |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность трихлорида бора
Хлорид бора вызывает ряд вопросов безопасности и опасности. Он коррозионно-активен и при контакте может вызвать серьезные ожоги кожи, глаз и дыхательных путей. Вдыхание его паров может вызвать раздражение дыхательных путей и повреждение легких. Соединение также очень реагирует с водой, выделяя токсичный газообразный хлористый водород. Крайне важно обращаться с хлоридом бора осторожно, используя соответствующие средства индивидуальной защиты и обеспечивая достаточную вентиляцию. В случае случайного воздействия необходима немедленная медицинская помощь. Кроме того, необходимо соблюдать надлежащие процедуры хранения и обращения, чтобы избежать риска возгорания, взрыва и выброса опасных газов.
| Символы опасности | Коррозионный (С) |
| Описание безопасности | Надевайте защитные перчатки/защиту глаз/лица. Не вдыхать пыль/дым/газ/туман/пары/спрей. Работайте в хорошо проветриваемом помещении. |
| Идентификационные номера ООН | ООН1741 |
| код ТН ВЭД | 2827390000 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | II |
| Токсичность | Очень токсичен при проглатывании или вдыхании. Может вызвать сильные ожоги и раздражение дыхательных путей. Обращайтесь с особой осторожностью. |
Методы синтеза трихлорида бора
Один из методов синтеза хлорида бора включает реакцию между оксидом бора (B2O3 ) и четыреххлористым углеродом (CCl4) в присутствии такого катализатора, как хлорид алюминия (AlCl3) . B2O3 и CCl4 реагируют при высоких температурах, образуя в качестве побочных продуктов хлорид бора и диоксид углерода.
Другой подход — прямая реакция между бором и газообразным хлором. В контролируемых условиях бор реагирует с хлором, в результате чего образуется хлорид бора. Этот метод требует осторожного обращения с газообразным хлором из-за его опасного характера.
Тионилхлорид (SOCl2) позволяет синтезировать хлорид бора путем реакции бора с SOCl2 при повышенных температурах, что приводит к образованию хлорида бора и газообразного диоксида серы.
Эти методы синтеза предлагают жизнеспособные пути производства хлорида бора как в лабораторных, так и в промышленных условиях. Крайне важно обеспечить надлежащие меры безопасности во время синтеза, такие как работа в хорошо проветриваемых помещениях и использование соответствующего защитного оборудования. Это важно из-за опасного характера реагентов и продуктов, участвующих в процессе.
Напишите применение трихлорида бора.
Хлорид бора широко используется в катализе, производстве полупроводников, синтезе материалов и других отраслях промышленности благодаря своим уникальным химическим свойствам и универсальности.
- Хлорид бора (BCl3) находит применение в качестве катализатора в различных химических реакциях, в частности в органическом синтезе. Он способствует образованию связей углерод-углерод и углерод-гетероатом при производстве фармацевтических препаратов, агрохимикатов и продуктов тонкой химии.
- BCl3 служит реагентом при синтезе полимеров на основе бора, таких как полиборазилен, которые применяются в огнезащитных и высокотемпературных покрытиях.
- BCl3 облегчает производство нитрида бора, материала, известного своей исключительной термической и химической стабильностью, широко используемого при высоких температурах и в качестве смазки.
- Полупроводниковая промышленность использует BCl3 в качестве легирующей добавки для включения атомов бора в кристаллы кремния, улучшая их электрические свойства и делая их пригодными для использования в электронных устройствах.
- В металлургии BCl3 действует как флюс для удаления оксидных примесей при рафинировании металлов, тем самым повышая их чистоту.
- BCl3 играет центральную роль в производстве карбида бора — легкого и прочного материала, широко используемого в производстве керамической брони и режущих инструментов.
- BCl3 играет решающую роль в синтезе многих борсодержащих соединений, в том числе эфиров бора, бороновых кислот и боранов. Эти соединения имеют множество применений в химических исследованиях и промышленных процессах.
- В нефтяной промышленности BCl3 используется в качестве присадки для повышения октанового числа бензина.
Он служит источником бора при производстве борсодержащего стекла, обладающего желаемыми оптическими и термическими свойствами.
Вопросы:
Вопрос: Какова формула трихлорида бора?
Ответ: Формула хлорида бора: BCl3.
Вопрос: Полярен ли трихлорид бора?
Ответ: Да, хлорид бора является полярной молекулой из-за наличия свободного дублета у атома бора и асимметричного расположения атомов хлора.
Вопрос: Что такое гибридизация бора в трихлориде бора (BCl3)?
Ответ: Гибридизация бора в BCl3 — это sp2.
Вопрос: Какова масса молекулы трихлорида бора?
Ответ: Масса молекулы хлорида бора (BCl3) составляет примерно 117,17 грамм на моль.
Вопрос: Что такое гибридизация трихлорида бора?
Ответ: Гибридизация бора в хлориде бора (BCl3) – это sp2.
Вопрос: Что произойдет, если смешать трихлорид бора и водород?
Ответ: Когда хлорид бора (BCl3) смешивается с водородом (H2), они реагируют с образованием бора и газообразного хлористого водорода (HCl).
Вопрос: Почему трихлорид бора существует в виде мономера, а трихлорид алюминия — в виде димера?
Ответ: Разница в размерах и электронной плотности между атомами бора и алюминия приводит к тому, что хлорид бора (BCl3) существует в виде мономера, тогда как хлорид алюминия (AlCl3) образует димер из-за своей способности образовывать координатные связи.
Вопрос: Является ли BCl3 кислотой Льюиса?
Ответ: Да, BCl3 является кислотой Льюиса, поскольку она может принимать пару электронов от основания Льюиса.
Вопрос: Является ли BCl3 ионным или ковалентным?
Ответ: BCl3 является ковалентным соединением.
Вопрос: Является ли BCl3 ковалентной связью?
Ответ: Да, BCl3 состоит из ковалентных связей между атомами бора и хлора.
Вопрос: Является ли BCl3 газом?
О: Да, BCl3 — это газ стандартной температуры и давления (STP).
Вопрос: Является ли BCl3 полярной или неполярной молекулой?
Ответ: BCl3 является полярной молекулой из-за неравномерного распределения электронной плотности, вызванного асимметричным расположением атомов хлора вокруг атома бора.
