Трибромид фосфора (PBr3) представляет собой соединение, состоящее из одного атома фосфора и трех атомов брома. Его используют в качестве реагента в различных химических реакциях, особенно при синтезе органических соединений.
| Название ИЮПАК | Трибромид фосфора |
| Молекулярная формула | ПБр3 |
| Количество CAS | 7789-60-8 |
| Синонимы | Бромид фосфора(III), бромид бромфосфора, трибромфосфин |
| ИнЧИ | ИнЧИ=1С/Бр3П/с1-4(2)3 |
Свойства трибромида фосфора
Формула трибромида фосфора
Формула бромида фосфора(III) – PBr3. Он состоит из одного атома фосфора и трех атомов брома. Это соединение образуется при реакции фосфора с бромом. Формула точно отражает состав соединения.
Молярная масса трибромида фосфора
Молярную массу бромида фосфора(III) можно рассчитать путем сложения атомных масс составляющих его элементов. Атомная масса фосфора составляет примерно 31,0 грамма на моль, а атомная масса брома составляет примерно 79,9 грамма на моль. Прибавление трехкратной атомной массы брома к атомной массе фосфора дает нам молярную массу бромида фосфора (III), которая составляет примерно 270,7 грамма на моль.
Температура кипения трибромида фосфора
Бромид фосфора(III) имеет температуру кипения около 173 градусов Цельсия. Это означает, что при температуре выше этой точки соединение претерпит фазовый переход из жидкости в газ. Температура кипения является важной характеристикой, которая помогает определить условия, при которых соединение можно использовать или очищать.
Точка плавления трибромида фосфора
Температура плавления бромида фосфора(III) составляет примерно -41 градус Цельсия. Эта температура указывает точку, в которой соединение переходит из твердого состояния в жидкое. Знание температуры плавления имеет решающее значение для обращения с соединением и манипулирования им в различных химических процессах.
Плотность трибромида фосфора г/мл
Плотность бромида фосфора (III) составляет примерно 2,85 грамма на миллилитр (г/мл). Плотность измеряет массу вещества в единице объема. Бромид фосфора(III) благодаря своей относительно высокой плотности плотнее многих других распространенных жидкостей, что указывает на его относительно тяжелый вес для своего объема.
Молекулярный вес трибромида фосфора
Молекулярная масса бромида фосфора(III) составляет примерно 270,7 грамма на моль. Это значение рассчитывается путем сложения атомных масс всех атомов соединения на основе молекулярной формулы PBr3. Молекулярный вес полезен при различных расчетах, включая определение количества вещества, присутствующего в данной массе.
Структура трибромида фосфора
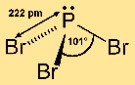
Бромид фосфора(III) имеет пирамидальную молекулярную структуру. Он состоит из центрального атома фосфора, связанного с тремя атомами брома. Такое расположение придает молекуле форму треугольной пирамиды с атомом фосфора наверху и атомами брома в основании. Эта структура важна для понимания реакционной способности и поведения соединения в химических реакциях.
Растворимость трибромида фосфора
Бромид фосфора(III) плохо растворим в воде. Реагирует с водой с образованием бромистоводородной кислоты и фосфористой кислоты. Однако он растворим в органических растворителях, таких как бензол и четыреххлористый углерод. Растворимость определяет степень, в которой соединение может растворяться в конкретном растворителе, что имеет значение для его применения и обращения с ним в различных процессах.
| Появление | Бесцветная жидкость |
| Удельный вес | 2,85 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 270,7 г/моль |
| Плотность | 2,85 г/мл |
| Точка плавления | -41°С |
| Точка кипения | 173°С |
| Мигающая точка | Нет в наличии |
| Растворимость в воде | Реагирует |
| Растворимость | Растворим в органических растворителях, таких как бензол и четыреххлористый углерод. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность трибромида фосфора
Бромид фосфора(III) представляет некоторую угрозу безопасности, и с ним следует обращаться с осторожностью. Он обладает коррозионным действием и может вызвать серьезные ожоги при попадании на кожу, в глаза или дыхательную систему. Вдыхание или прямое проглатывание этого соединения может вызвать раздражение дыхательных путей и желудочно-кишечного тракта. Он бурно реагирует с водой, выделяя токсичные пары и выделяя тепло. При работе с бромидом фосфора(III) следует использовать соответствующую вентиляцию и средства индивидуальной защиты, такие как перчатки и очки. Кроме того, его следует хранить вдали от несовместимых веществ, чтобы избежать возможных реакций. В целом, строгое соблюдение протоколов безопасности и знание опасностей, связанных с этим соединением, необходимы для безопасного обращения.
| Символы опасности | Коррозионный |
| Описание безопасности | Ручка с залогом. Избегайте контакта с кожей, глазами и дыхательной системой. Используйте соответствующую вентиляцию и средства индивидуальной защиты. Хранить вдали от несовместимых веществ. |
| Идентификационные номера ООН | ООН 1805 |
| код ТН ВЭД | 2812.90.90 |
| Класс опасности | 8 (Коррозионный) |
| Группа упаковки | II |
| Токсичность | Токсично при вдыхании и проглатывании. Может вызвать сильные ожоги и раздражение. |
Методы синтеза трибромида фосфора
В обычном методе синтеза бромида фосфора (III) в реакционном сосуде непосредственно соединяются элементарный фосфор и бром, обычно в контролируемых условиях. Реакция протекает с переносом атомов брома на атомы фосфора, в результате чего образуется бромид фосфора(III).
Другой метод включает реакцию между трихлоридом фосфора (PCl3) и бромистым водородом (HBr) . При таком подходе трихлорид фосфора сначала реагирует с газообразным бромистым водородом, образуя бромид фосфора (III) и газообразный хлористый водород в качестве побочных продуктов. Этот метод предлагает альтернативный путь получения бромида фосфора(III).
В «методе красного фосфора» красный фосфор смешивают с бромом или бромистоводородной кислотой, и реакцию проводят в контролируемых условиях. Красный фосфор служит источником фосфора, реагируя с бромом или бромистоводородной кислотой с образованием бромида фосфора(III).
Эти синтетические методы открывают возможности для производства бромида фосфора (III), каждый из которых имеет свои преимущества и особенности. Выбор метода зависит от таких факторов, как доступность реагента, желаемый выход и конкретные условия реакции. Важно проводить этот синтез в хорошо оборудованной лаборатории, соблюдая протоколы безопасности и процедуры обращения с используемыми химическими веществами.
Использование трибромида фосфора
Бромид фосфора(III) находит разнообразное применение благодаря своей реакционной способности и уникальным свойствам. Вот некоторые из его применений:
- Органический синтез. Химики широко используют бромид фосфора (III) в качестве реагента в органическом синтезе для преобразования спиртов в алкилбромиды, что является ключевым этапом синтеза многих органических соединений.
- Фармацевтическая промышленность. Производство фармацевтических препаратов в значительной степени зависит от бромида фосфора (III) для синтеза различных промежуточных продуктов лекарств и активных фармацевтических ингредиентов (API).
- Антипирены: производители используют бромид фосфора (III) при производстве антипиренов, улучшая огнестойкие свойства некоторых полимеров для использования в таких отраслях, как электроника и текстиль.
- Химическое производство: Бромид фосфора(III) служит ценным промежуточным продуктом в производстве других химических веществ, включая соединения фосфора, такие как производные фосфорной кислоты, фосфонаты и фосфаты.
- Гербициды и пестициды: при синтезе конкретных активных ингредиентов, используемых в гербицидах и пестицидах, бромид фосфора (III) используется для эффективной борьбы с сорняками, вредителями и болезнями в сельском хозяйстве.
- Лабораторные исследования: В лаборатории исследователи обычно используют бромид фосфора (III) в качестве реагента в различных экспериментах и реакциях, особенно тех, которые связаны с бромированием и манипуляциями с органическими соединениями.
- Химический анализ: Бромид фосфора (III) находит применение в методах химического анализа, позволяя определять наличие определенных функциональных групп в органических соединениях посредством реакций замещения брома.
Такое разнообразное использование подчеркивает важность бромида фосфора (III) в органическом синтезе, фармацевтике, антипиренах, химическом производстве, сельском хозяйстве, лабораторных исследованиях и химическом анализе. Его реакционная способность и универсальность делают его ценным соединением в различных отраслях промышленности и научных дисциплинах.
Вопросы:
Вопрос: Почему AlBr3 называется бромидом алюминия, а PBr3 — трибромидом фосфора?
Ответ: В соглашении об именах соединений, содержащих металлы, обычно используется название элемента металла, за которым следует название неметалла, тогда как в случае PBr3 фосфор указывается, чтобы указать на наличие центрального атома фосфора.
Вопрос: Какое слово или фраза из двух слов лучше всего описывает форму трибромида фосфора?
Ответ: Форму бромида фосфора(III) лучше всего описать как тригонально-пирамидальную.
Вопрос: Сколько валентных электронов в молекуле трибромида фосфора PBr3?
A: Бромид фосфора(III) (PBr3) имеет 26 валентных электронов.
Вопрос: Является ли трибромид фосфора ионным или ковалентным?
A: Бромид фосфора(III) (PBr3) представляет собой ковалентное соединение.
Вопрос: Какова химическая формула трибромида фосфора?
A: Химическая формула бромида фосфора(III) — PBr3.
Вопрос: Структура Льюиса трибромида фосфора PBr3?
A: Структура Льюиса PBr3 показывает фосфор как центральный атом, окруженный тремя связанными атомами брома, каждый из которых соединен одинарной связью.
Вопрос: PBr3 — это инверсия?
Ответ: Нет, бромид фосфора(III) (PBr3) не проявляет инверсию.
Вопрос: Является ли PBr3 электрофилом?
Ответ: Да, PBr3 может действовать как электрофил в определенных реакциях, принимая электроны.
Вопрос: Какова молекулярная геометрия PBr3?
Ответ: Молекулярная геометрия PBr3 является тригонально-пирамидальной.
Вопрос: PBr3 полярный или неполярный?
A: PBr3 является полярной молекулой из-за неравномерного распределения электронной плотности, вызванного наличием полярных связей P-Br.
Вопрос: Сколько молей PBr3 содержат 3,68 × 10^25 атомов брома?
Ответ: Для определения количества молей нам нужна молярная масса PBr3, затем делим заданное количество атомов брома на число Авогадро.
Вопрос: Как правильно называть PBr3?
Ответ: Правильное название PBr3 — бромид фосфора(III).
Вопрос: Полярен ли PBr3?
Ответ: Да, PBr3 является полярной молекулой из-за наличия полярных связей и неравномерного распределения электронной плотности.
