Тиосульфат натрия – химическое соединение формулы Na2S2O3. Он обычно используется в качестве фиксатора при обработке фотографий и в качестве восстановителя в некоторых химических реакциях.
| Название ИЮПАК | Тиосульфат натрия |
| Молекулярная формула | Na2S2O3 |
| Количество CAS | 7772-98-7 |
| Синонимы | Гипосульфит натрия, тиосульфат натрия, динатриевая соль тиосерной кислоты, пентагидрат тиосульфата натрия |
| ИнЧИ | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Свойства тиосульфата натрия
Формула тиосульфата натрия
Химическая формула тиосульфата натрия: Na2S2O3. Он состоит из двух ионов Na+ и двух ионов S2O3 2-. Формула показывает типы и количество атомов, присутствующих в молекуле соединения.
Молярная масса тиосульфата натрия
Молярная масса Na2S2O3 составляет 158,11 г/моль. Его рассчитывают путем сложения атомных масс всех атомов, присутствующих в одном моле соединения. Это значение полезно для определения количества Na2S2O3, необходимого для конкретной реакции, или для расчета концентрации раствора.
Температура кипения тиосульфата натрия
Na2S2O3 не имеет точки кипения, поскольку он разлагается, не достигнув точки кипения. При нормальном давлении он разлагается при температуре от 48 до 55°C с выделением диоксида серы. Это свойство делает его непригодным для применения при высоких температурах.
Тиосульфат натрия Температура плавления
Температура плавления Na2S2O3 составляет 48,3°С. Это температура, при которой твердое соединение переходит в жидкое состояние. Его температура плавления относительно низкая по сравнению с другими неорганическими солями, что позволяет легко растворять его в воде.
Плотность тиосульфата натрия г/мл
Плотность Na2S2O3 составляет 1,667 г/мл. Это значение относится к массе вещества в единице объема. Она больше плотности воды, а это значит, что Na2S2O3 тонет в воде.
Молекулярный вес тиосульфата натрия
Молекулярная масса Na2S2O3 составляет 158,11 г/моль. Это сумма атомных весов всех атомов, присутствующих в молекуле соединения. Молекулярный вес полезен для определения количества Na2S2O3, необходимого для конкретной реакции, или для расчета концентрации раствора.
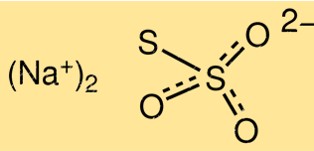
Структура тиосульфата натрия
Структура Na2S2O3 состоит из двух ионов S2O3 2-, связанных с ионом натрия Na+. Молекула имеет форму треугольной пирамиды с валентным углом примерно 103 градуса. Тиосульфат-ион имеет одну связь сера-сера и две связи сера-кислород.
Растворимость тиосульфата натрия
Na2S2O3 хорошо растворим в воде. Растворимость Na2S2O3 в воде увеличивается с температурой: примерно 70 г соединения растворяется в 100 мл воды при 25°C. Он также растворим в глицерине и мало растворим в спирте. Его растворимость делает его полезным в различных приложениях, таких как обработка фотографий и медицинское лечение.
| Появление | Белый кристаллический порошок |
| Удельный вес | 1667 г/мл |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 158,11 г/моль |
| Плотность | 1667 г/мл |
| Точка плавления | 48,3°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в глицерине и мало растворим в спирте. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нейтральный (pH 7) |
Безопасность и опасность тиосульфата натрия
Na2S2O3 обычно считается безопасным при правильном обращении. Однако он может быть вредным при проглатывании, вдыхании или при попадании в глаза или на кожу. Соединение может вызвать раздражение кожи и глаз, а длительное воздействие может привести к дерматиту. Проглатывание Na2S2O3 может вызвать желудочно-кишечный дискомфорт, например тошноту и рвоту. При работе с Na2S2O3 важно носить соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки. В случае воздействия пораженный участок следует промыть водой и при необходимости обратиться за медицинской помощью.
| Символы опасности | Никто |
| Описание безопасности | Избегайте контакта с глазами, кожей и одеждой. Не глотать. Носите соответствующие средства индивидуальной защиты. |
| Идентификационные номера ООН | ООН3077 |
| код ТН ВЭД | 2832.3010.00 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | Низкая токсичность; LD50 (перорально, крыса) составляет 6200 мг/кг. |
Методы синтеза тиосульфата натрия
Синтезировать Na2S2O3 можно различными методами.
Распространенным методом является реакция сульфита натрия с серой в присутствии щелочного раствора. Другой метод включает реакцию сульфита натрия с диоксидом серы под давлением.
Один из способов получения Na2S2O3 — растворение серы в горячем растворе сульфита натрия и гидроксида натрия . Раствор охлаждается, и кто-то фильтрует его, чтобы получить твердый продукт.
В этом методе диоксид серы взаимодействует с гидроксидом натрия с образованием сульфита натрия, а затем с элементарной серой с получением Na2S2O3.
Чтобы получить Na2S2O3, серную кислоту можно ввести в реакцию с сульфитом натрия, затем нагреть полученный раствор и добавить серу. Сульфит натрия затем вступит в реакцию с серой с образованием Na2S2O3.
Другой метод предполагает взаимодействие гидроксида натрия с серой с последующим добавлением сульфита натрия с образованием Na2S2O3.
Применение тиосульфата натрия
Na2S2O3 имеет широкий спектр применения в различных отраслях промышленности и применениях, в том числе:
- Фотография: используется в качестве фиксирующего средства для удаления неэкспонированного галогенида серебра с фотоотпечатков и пленок.
- Очистка воды: используется для дехлорирования воды путем нейтрализации хлора и предотвращения его вредного воздействия на водную жизнь.
- Медицинское применение: используется при лечении отравления цианидами, поскольку вступает в реакцию с цианидом с образованием тиоцианата, который менее токсичен и может выводиться из организма.
- Промышленное применение: используется в качестве восстановителя в химических процессах и в качестве консерванта в текстиле, коже и бумаге.
- Аналитическая химия: используется в качестве титранта при анализе различных металлов, таких как медь и мышьяк.
- Пищевая промышленность и производство напитков: используется в качестве пищевого консерванта для предотвращения изменения цвета и усилителя вкуса.
- Садоводство: используется для нейтрализации воздействия хлора в воде, используемой для орошения растений.
Вопросы:
Вопрос: Для чего используется тиосульфат натрия?
Ответ: Na2S2O3 имеет широкий спектр применений, включая фотографию, очистку воды, медицинские процедуры, промышленные процессы, аналитическую химию, консервацию продуктов питания и напитков, а также садоводство.
Вопрос: Как сделать тиосульфат натрия?
Ответ: Na2S2O3 можно синтезировать путем взаимодействия сульфита натрия с серой или диоксидом серы в присутствии щелочного раствора. Другие методы включают реакцию гидроксида натрия с серой или диоксидом серы с образованием сульфита натрия, который затем реагирует с серой с образованием Na2S2O3.
Вопрос: Что такое тиосульфат натрия и золота?
Ответ: Золото Na2S2O3 представляет собой сложное соединение, образующееся в результате реакции хлорида золота и Na2S2O3. Он используется в золочение и аналитической химии для обнаружения и количественного определения золота.
Вопрос: Где купить тиосульфат натрия?
О: Na2S2O3 можно приобрести у поставщиков химикатов, компаний, занимающихся поставками лабораторных материалов, и в интернет-магазинах.
Вопрос: Где я могу найти тиосульфат натрия?
Ответ: Na2S2O3 можно найти в различных продуктах, включая фотохимикаты, средства для очистки воды и медицинские средства.
Вопрос: Какова степень окисления серы в Na2S2O3?
A: Степень окисления серы в Na2S2O3 равна +2 по тиосульфат-иону (S2O3^2-) и +6 по сульфат-иону (SO4^2-).
Вопрос: Как найти массу Cu методом титрования Na2S2O3?
Ответ: Вес Cu можно рассчитать по объему и молярности раствора Na2S2O3, используемого при титровании, используя сбалансированное химическое уравнение реакции между Cu и Na2S2O3.
Вопрос: Как узнать, что добавлено стехиометрическое количество Na2S2O3?
Ответ: Стехиометрическое количество Na2S2O3 было добавлено при достижении конечной точки реакции, на что указывает изменение цвета или других физических или химических свойств.
Вопрос: Если к 40 каплям Na2S2O3 добавить 5 капель 0,15 М KI, какова будет конечная концентрация KI?
О: Конечную концентрацию KI невозможно определить без дополнительной информации, такой как объем или концентрация раствора Na2S2O3.
Вопрос: Как найти молярность Na2S2O3?
A: Молярность Na2S2O3 можно рассчитать, исходя из массы образца, а также объема и концентрации раствора, используемого для его растворения, по формуле Молярность = моль растворенного вещества/объем раствора в литрах.
