Сульфурилхлорид (SO2Cl2) представляет собой соединение, образованное сочетанием диоксида серы и хлора. Его используют в качестве реагента в химических реакциях и как фумигант для борьбы с вредителями.
| Название ИЮПАК | Сульфурилхлорид |
| Молекулярная формула | SO2Cl2 |
| Количество CAS | 7791-25-5 |
| Синонимы | Дихлорид серы, оксихлорид серы, оксид дихлорида серы |
| ИнЧИ | InChI=1S/Cl2O2S/c1-5(2)6(3)4 |
Свойства сульфурилхлорида
Формула сульфурилхлорида
Химическая формула дихлорида серы — SO2Cl2. Он образуется в результате соединения одного атома серы, двух атомов кислорода и двух атомов хлора. Эта формула представляет состав и расположение атомов в молекуле дихлорида серы.
Молярная масса сульфурилхлорида
Молярную массу дихлорида серы можно рассчитать путем сложения атомных масс составляющих его элементов. Дихлорид серы имеет молярную массу примерно 134,97 грамма на моль. Эта величина важна для различных расчетов химических реакций и стехиометрии.
Температура кипения сульфурилхлорида
Дихлорид серы имеет температуру кипения около 69 градусов по Цельсию. Когда температура поднимается выше этой точки, дихлорид серы претерпевает фазовый переход, переходя из жидкости в газ. Температура кипения является решающим параметром при определении условий, при которых дихлорид серы можно использовать или обращаться с ним.
Температура плавления сульфурилхлорида
Температура плавления дихлорида серы составляет примерно -54 градуса Цельсия. При температуре ниже этой точки дихлорид серы переходит из твердого состояния в жидкое. Температура плавления важна для хранения и обращения с дихлоридом серы, поскольку она указывает на условия, при которых он затвердевает или сжижается.
Плотность сульфурилхлорида г/мл
Плотность дихлорида серы составляет примерно 1,638 грамма на миллилитр (г/мл). Плотность представляет собой массу вещества на единицу объема и помогает определить его физическое поведение. Плотность дихлорида серы важна для понимания его плавучести, растворимости и совместимости с другими веществами.
Сульфурилхлорид Молекулярный вес
Молекулярная масса дихлорида серы составляет примерно 134,97 атомных единиц массы (ед.). Это сумма атомных масс составляющих атомов молекулы дихлорида серы. Молекулярный вес предоставляет важную информацию для различных химических расчетов и определения количества вещества в данном образце.
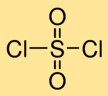
Структура сульфурилхлорида
Дихлорид серы имеет молекулярную структуру, в которой один атом серы связан двойной связью с двумя атомами кислорода и одинарной связью с двумя атомами хлора. Такое расположение образует центральный атом серы, окруженный атомами кислорода и хлора, что придает дихлориду серы его характерную структуру.
Растворимость сульфурилхлорида
Дихлорид серы плохо растворяется в воде. Он реагирует с водой с образованием соляной кислоты и серной кислоты, что делает его гидролитически активным. Однако дихлорид серы обладает некоторой растворимостью в органических растворителях, таких как хлорированные углеводороды и ароматические соединения, что делает их пригодными для определенных применений.
| Появление | Бесцветная жидкость |
| Удельный вес | 1638 г/мл |
| Цвет | Н/Д |
| Запах | Острый, удушающий |
| Молярная масса | 134,97 г/моль |
| Плотность | 1638 г/мл |
| Точка плавления | -54°С |
| Точка кипения | 69°С |
| Мигающая точка | Н/Д |
| Растворимость в воде | Реагирует бурно |
| Растворимость | Растворим в органических растворителях, таких как хлорированные углеводороды и ароматические соединения. |
| Давление газа | 43,6 мм рт.ст. (при 25°С) |
| Плотность пара | 4,43 (воздух = 1) |
| пКа | Н/Д |
| рН | Н/Д |
Безопасность и опасность сульфурилхлорида
Дихлорид серы представляет собой ряд опасностей, поэтому при обращении с ним следует соблюдать меры предосторожности. Это едкое вещество, которое при контакте может вызвать серьезные ожоги кожи, глаз и дыхательных путей. Прямое вдыхание его паров может вызвать раздражение дыхательных путей и повреждение легких. Он бурно реагирует с водой, выделяя токсичные газы и создавая опасность взрыва. Поэтому важно обращаться с дихлоридом серы в хорошо проветриваемом помещении и носить соответствующие защитные средства, такие как перчатки, очки и средства защиты органов дыхания. Разливы следует немедленно убирать с использованием соответствующих процедур и хранить в прохладном, сухом месте вдали от несовместимых материалов.
| Символы опасности | Коррозионное (C), Окисляющее (O) |
| Описание безопасности | Вызывает серьезные ожоги кожи и повреждения глаз. Интенсивно Реагирует с водой. |
| Идентификационные номера ООН | ООН 1834 (Дихлорид серы) |
| код ТН ВЭД | 28121000 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Очень токсичен; Вреден при проглатывании, вдыхании или попадании через кожу. |
Методы синтеза сульфурилхлорида
Люди обычно используют несколько методов для синтеза дихлорида серы.
Один метод включает реакцию между диоксидом серы (SO2) и газообразным хлором (Cl2) . В присутствии катализатора, такого как активированный уголь или хлорид алюминия, газы реагируют с образованием дихлорида серы (SO2Cl2). Эта реакция обычно происходит при высоких температурах, от 100 до 200°C.
Другой метод синтеза сернистого дихлорида включает реакцию триоксида серы (SO3) с хлористым водородом (HCl). В контролируемых условиях эти два соединения объединяются с образованием дихлорида серы. Эта реакция является экзотермической и обычно протекает в газовой фазе.
В процессе тионилхлорида образуется дихлорид серы в результате реакции серной кислоты (H2SO4) с пентахлоридом фосфора (PCl5) при комнатной температуре. В результате этой реакции образуется дихлорид серы, а также побочные продукты, такие как фосфорная кислота (H3PO4) и хлористый водород (HCl). Этот метод обычно используется в промышленных условиях.
Важно отметить, что эти методы синтеза требуют осторожного обращения с реагентами и соблюдения мер предосторожности из-за реакционной способности и опасной природы используемых веществ.
Кроме того, химики часто используют соответствующее оборудование, такое как конденсаторы и дефлегмационные системы, для контроля условий реакции и обеспечения успешного синтеза дихлорида серы.
Использование сульфурилхлорида
Дихлорид серы (SO2Cl2) благодаря своим уникальным свойствам находит разнообразное применение в различных отраслях промышленности. Вот некоторые ключевые области применения дихлорида серы:
- Химический реагент: В органическом синтезе дихлорид серы обычно используется в качестве универсального химического реагента, где он активно участвует в различных реакциях, включая хлорирование, сульфирование и этерификацию, позволяя вводить хлор, серу или кислоту в органические соединения.
- Пестициды и фумиганты: дихлорид серы действует как мощный фумигант для борьбы с вредителями в хранилищах зерна, на мукомольных заводах и предприятиях пищевой промышленности, активно уничтожая насекомых, личинок и вредителей, которые могут повредить хранящуюся сельскохозяйственную продукцию из-за своих сильных биоцидных свойств.
- Полимеризация: при полимеризации конкретных мономеров, таких как винилхлорид, дихлорид серы служит активным катализатором или инициатором, облегчая производство поливинилхлорида (ПВХ), широко используемого термопластичного полимера, который применяется в строительстве, автомобильной и электроэнергетической промышленности.
- Фармацевтика: Дихлорид серы активно играет решающую роль в синтезе фармацевтических соединений, особенно сульфаниламидов, которые являются незаменимыми антибиотиками и терапевтическими средствами, используемыми для лечения различных инфекций.
- Производство красителей: Дихлорид серы активно участвует в производстве красителей, особенно содержащих серу или хлор. Он активно вводит желаемые функциональные группы и улучшает стойкость цвета и стабильность красителя.
- Химические промежуточные соединения: дихлорид серы служит активным промежуточным продуктом в синтезе других химических веществ, включая диоксид серы, серную кислоту и сульфонилхлориды, которые находят применение во многих отраслях промышленности, таких как производство моющих средств, производство пластмасс и фармацевтика.
- Очистка воды: Для очистки и дезинфекции воды дихлорид серы активно нейтрализует и уничтожает вредные бактерии, вирусы и другие микроорганизмы, присутствующие в источниках воды.
- Лабораторное применение: Дихлорид серы активно используется в различных лабораторных процедурах, например, для обнаружения и определения первичных и вторичных аминов. Он активно реагирует с аминами с образованием стабильных сульфаниламидов, что облегчает их анализ и характеристику.
Вопросы:
Вопрос: Каково общее количество грамм-молекул SO2Cl2 в 13,5 г сульфурилхлорида?
A: Общее количество грамм-молекул SO2Cl2 в 13,5 г сульфурилхлорида можно рассчитать, разделив данную массу на молярную массу SO2Cl2.
Вопрос: SO2Cl2 полярный или неполярный?
Ответ: SO2Cl2 является полярной молекулой из-за наличия полярных связей и асимметричной молекулярной геометрии.
Вопрос: Когда снизится давление SO2Cl2?
Ответ: Падение давления SO2Cl2 зависит от различных факторов, таких как температура, объем и условия реакции. Это невозможно определить, основываясь только на времени.
Вопрос: Каково парциальное давление SO2Cl2 в этой смеси?
Ответ: Парциальное давление SO2Cl2 в смеси можно определить с помощью закона идеального газа в зависимости от температуры, объема и мольной доли или концентрации SO2Cl2.
Вопрос: Какие типы межмолекулярных сил ожидаются между молекулами SO2Cl2?
A: Ожидаемые межмолекулярные силы между молекулами SO2Cl2 включают диполь-дипольные взаимодействия и дисперсионные силы Лондона.
Вопрос: В какой момент парциальное давление SO2Cl2 уменьшится до одной десятой от первоначального значения?
Ответ: Время, необходимое для снижения парциального давления SO2Cl2 до одной десятой его первоначального значения, зависит от конкретных условий системы и скорости протекающей химической реакции.
Вопрос: Какова молярная масса SO2Cl2?
A: Молярная масса SO2Cl2 составляет примерно 134,97 грамма на моль.
Вопрос: Какова молекулярная геометрия SO2Cl2?
A: Молекулярная геометрия SO2Cl2 изогнута или V-образна, с атомом серы в центре, связанным с двумя атомами кислорода и двумя атомами хлора.
Вопрос: Какова структура Льюиса SO2Cl2?
Ответ: Структура Льюиса SO2Cl2 состоит из атома серы, связанного двойной связью с атомом кислорода и одинарной связи с другим атомом кислорода, а также двух атомов хлора, связанных с атомом серы.
