Пероксид калия (K2O2) представляет собой соединение калия и кислорода. Его часто используют в качестве сильного окислителя в промышленности и лабораториях для облегчения различных химических реакций.
| Название ИЮПАК | Пероксиоксиданид калия |
| Молекулярная формула | К2О2 |
| Количество CAS | 17014-71-0 |
| Синонимы | Супероксид калия; Диоксид калия; диоксид калия; Оксид перкалия |
| ИнЧИ | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Свойства перекиси калия
Формула перекиси калия
Химическая формула перекиси калия – K2O2. Эта формула представляет количество и тип атомов, присутствующих в молекуле. Формула важна для идентификации вещества и понимания его химических свойств.
Молярная масса пероксида калия
Молярная масса K2O2 составляет 110,2 г/моль. Это означает, что один моль K2O2 весит 110,2 грамма. Молярная масса является важным свойством вещества, поскольку позволяет рассчитать количество вещества, присутствующего в данной массе или объеме.
Температура кипения перекиси калия
K2O2 не имеет определенной температуры кипения, поскольку он разлагается, не достигнув точки кипения. При высоких температурах K2O2 разлагается на оксид калия и газообразный кислород. Поэтому его обычно не используют при высоких температурах.
Температура плавления перекиси калия
Температура плавления K2O2 составляет 655°С. Высокая температура плавления делает его подходящим окислителем в высокотемпературных реакциях. Однако важно отметить, что он может разложиться, не достигнув точки плавления, при воздействии высоких температур или влажности.
Плотность пероксида калия г/мл
Плотность K2O2 составляет 2,08 г/мл. Высокая плотность делает его плотным твердым веществом, которое тонет в воде. Плотность K2O2 также важна при определении его растворимости в различных растворителях.
Молекулярный вес пероксида калия
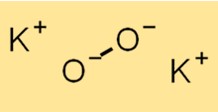
Молекулярная масса K2O2 составляет 110,2 г/моль. Эта величина представляет собой сумму атомных весов всех атомов, присутствующих в молекуле. Молекулярный вес — важное свойство, используемое для расчета различных свойств вещества, включая его молярную массу и плотность.
Структура перекиси калия
Структура K2O2 состоит из катиона K+ и аниона O2^2-. Анион О2^2- состоит из двух атомов кислорода, связанных между собой ковалентно. Структура K2O2 важна для понимания его химических свойств и реакционной способности.
| Появление | Твёрдое вещество от белого до бледно-жёлтого цвета |
| Удельный вес | 2.08 |
| Цвет | От белого до бледно-желтого |
| Запах | Без запаха |
| Молярная масса | 110,2 г/моль |
| Плотность | 2,08 г/мл |
| Точка плавления | 655°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует с водой |
| Растворимость | Нерастворим в органических растворителях |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасности перекиси калия
K2O2 представляет несколько рисков для безопасности из-за своих сильных окислительных свойств. Он может энергично реагировать с водой или влагой, выделяя газообразный кислород и выделяя тепло. Эта реакция потенциально может привести к пожару или взрыву, если с ней обращаться неправильно. Кроме того, при контакте он может вызвать раздражение кожи и глаз, а вдыхание его пыли может вызвать проблемы с дыханием. Важно обращаться с K2O2 осторожно, носить соответствующие средства индивидуальной защиты и хранить его в сухом прохладном месте, вдали от источников тепла и несовместимых материалов. В случае случайного воздействия немедленно обратитесь за медицинской помощью.
| Символы опасности | Окислитель |
| Описание безопасности | Не подвергайте воздействию воды. Надевайте защитные перчатки и средства защиты глаз/лица. Хранить в сухом прохладном месте, вдали от источников тепла и несовместимых материалов. |
| Идентификационные номера ООН | ООН1504 |
| код ТН ВЭД | 2829.90.90 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Может вызвать раздражение кожи и глаз. Вдыхание пыли может вызвать проблемы с дыханием. |
Методы синтеза пероксида калия
Существует несколько методов синтеза K2O2, в том числе реакция гидроксида калия с пероксидом водорода , реакция гидроксида калия с пероксидом бария и термическое разложение супероксида калия.
Первый метод заключается в медленном добавлении гидроксида калия к раствору перекиси водорода при перемешивании до образования белого осадка K2O2. Процесс включает фильтрацию смеси и промывку твердого вещества холодной водой для удаления примесей.
Во втором методе суспензию пероксида бария перемешивают, добавляя при этом раствор гидроксида калия . Смесь фильтруют и фильтрат упаривают досуха. Затем нагрейте полученное твердое вещество до высокой температуры, чтобы разложить оставшуюся пероксид бария и образовать K2O2.
Третий метод включает нагревание супероксида калия до высокой температуры, в результате чего он разлагается на K2O2 и газообразный кислород.
Использование перекиси калия
K2O2 имеет несколько применений в различных отраслях промышленности благодаря своим окислительным свойствам. Некоторые из его применений включают в себя:
- Отбеливатель: используется в качестве отбеливателя для текстиля и бумажных изделий, а также в средствах для отбеливания волос и зубов.
- Источник кислорода: используется в качестве источника кислорода в закрытых системах, например, на подводных лодках, где он может выделять кислород при смешивании с водой.
- Полимеризация: используется при полимеризации некоторых мономеров для производства полимеров, например, при синтезе полистирола.
- Восстановление почвы: используется для восстановления почвы с целью удаления органических загрязнений, таких как разливы нефти.
- Аналитическая химия: используется в аналитической химии в качестве окислителя для определения присутствия определенных соединений.
- Ракетное топливо: используется в качестве окислителя в ракетном топливе из-за его способности выделять кислород.
- Химический синтез: используется при синтезе различных органических и неорганических соединений, например при синтезе перманганата калия.
Вопросы:
Вопрос: Что лучше: перекись водорода или гидроксид калия?
О: Это зависит от предполагаемого использования. Перекись водорода является мощным окислителем и обычно используется в качестве дезинфицирующего средства, отбеливателя, а также отбеливателя для волос и зубов. С другой стороны, гидроксид калия является сильным основанием и обычно используется в производстве мыла и моющих средств, а также в производстве биодизеля из растительных масел.
Вопрос: Каковы химические формулы супероксида калия, пероксида калия и оксида калия?
A: Химические формулы: K2O2 для супероксида калия, K2O2 для пероксида калия и K2O для оксида калия.
Вопрос: Что образуется при взаимодействии перекиси водорода с йодидом и йодатом калия?
Ответ: При взаимодействии перекиси водорода с йодидом и йодатом калия образуется йод по следующей реакции: H2O2 + KI + KIO3 → I2 + K2O + H2O.
Вопрос: Какова степень окисления атома кислорода в K2O2?
Ответ: Степень окисления атома кислорода в K2O2 равна -1.
Вопрос: Какова степень окисления К в K2O2?
Ответ: Степень окисления K в K2O2 равна +1.
