Перекись водорода или H2O2 представляет собой бледно-голубую жидкость с сильными окислительными свойствами. Его обычно используют в качестве дезинфицирующего средства, отбеливателя и в ракетах в качестве топлива. В высоких концентрациях может быть вреден.
| Название ИЮПАК | диоксид водорода |
| Молекулярная формула | H2O2 |
| Количество CAS | 7722-84-1 |
| Синонимы | Диоксид водорода, пероксид, оксидол, супероксол, диоксид гидроксония, пероксаан, асептик и т. д. |
| ИнЧИ | ИнЧИ=1S/H2O2/c1-2/h1-2H |
Свойства перекиси водорода
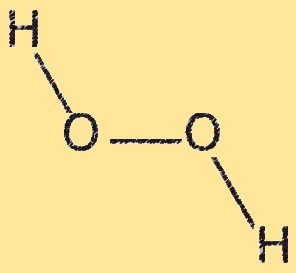
Структура H2O2
Перекись водорода имеет изогнутую молекулярную структуру с углом между двумя атомами кислорода примерно 104,5 градуса. Молекула имеет две связи ОН и одну связь ОО. Связь ОО слабая и легко разрывается, что делает перекись водорода сильным окислителем. Изогнутая структура перекиси водорода возникает в результате отталкивания неподеленных пар электронов на атомах кислорода.
Формула перекиси водорода
Химическая формула перекиси водорода — H2O2, что указывает на то, что каждая молекула перекиси водорода содержит два атома водорода и два атома кислорода. Формула представляет собой краткий способ представления молекулярного состава вещества. Химическая формула перекиси водорода важна для понимания ее свойств и реакций с другими веществами.
Молярная масса перекиси водорода
Перекись водорода имеет молярную массу примерно 34,01 г/моль. Молярная масса — это сумма атомных масс всех атомов молекулы соединения. Перекись водорода имеет два атома водорода и два атома кислорода в каждой молекуле, поэтому ее молярная масса рассчитывается путем сложения атомной массы каждого атома. Молярная масса является важным свойством вещества, поскольку она используется в расчетах стехиометрии для определения количества вещества, присутствующего в данном образце.
Температура кипения перекиси водорода
Температура кипения перекиси водорода составляет 150,2°C (302,4°F). Эта температура является точкой, при которой давление паров жидкости равняется атмосферному давлению. Выше этой температуры жидкость превращается в газ, а ниже этой температуры остается в жидком состоянии. Температура кипения перекиси водорода выше, чем у воды, которая кипит при 100°С, из-за наличия в перекиси водорода межмолекулярных водородных связей.
Температура плавления перекиси водорода
Температура плавления перекиси водорода составляет -0,43°C (31,23°F). Эта температура является точкой, при которой твердое и жидкое состояния вещества находятся в равновесии. При этой температуре твердая форма перекиси водорода плавится в жидкость. Температура плавления перекиси водорода ниже, чем у воды, которая плавится при 0°C, из-за нестабильной природы молекулы перекиси водорода.
Плотность перекиси водорода г/мл
Плотность перекиси водорода составляет 1,11 г/мл при стандартной температуре и давлении (СТП). Это означает, что один миллилитр перекиси водорода весит 1,11 грамма. Плотность перекиси водорода больше, чем у воды, плотность которой составляет 1 г/мл, из-за присутствия в перекиси водорода более тяжелых атомов кислорода.
Молекулярный вес перекиси водорода
Молекулярная масса перекиси водорода составляет 34,01 г/моль. Это значение рассчитывается путем сложения атомных масс каждого атома в молекуле перекиси водорода. Молекулярная масса — важное свойство вещества, поскольку ее используют в различных расчетах, в том числе при определении концентрации перекиси водорода в растворе.
| Появление | Прозрачная бесцветная жидкость |
| Удельный вес | 1,11 г/см3 при 20°С |
| Цвет | Бледно-голубой (чистая форма) |
| Запах | Почти без запаха (чистая форма) |
| Молярная масса | 34,01 г/моль |
| Плотность | 1,11 г/мл при 20°C |
| Точка плавления | -0,43°С |
| Точка кипения | 150,2°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Полностью смешивается с водой |
| Растворимость | Растворим в спирте, эфире и других органических растворителях. |
| Давление газа | 23,3 мм рт.ст. при 20°C |
| Плотность пара | 1,1 (воздух = 1) |
| пКа | 11,6 (при 25°С) |
| рН | 4,5 – 6,0 (10% раствор) |
Примечание. Эти значения являются типичными и могут варьироваться в зависимости от чистоты, концентрации и других факторов.
Безопасность и опасности перекиси водорода
Перекись водорода может быть опасна при неправильном обращении. Это сильный окислитель, который может бурно реагировать с органическими и неорганическими веществами, что может привести к пожару или взрыву. Концентрированная форма перекиси водорода также вызывает коррозию и может вызвать серьезные ожоги или повреждение тканей при попадании на кожу или в глаза. Вдыхание паров перекиси водорода может вызвать раздражение дыхательных путей, а проглатывание может привести к серьезным внутренним повреждениям или смерти. Поэтому при работе с перекисью водорода следует принимать соответствующие меры безопасности, такие как ношение защитной одежды и перчаток, избежание контакта с несовместимыми веществами и использование в хорошо проветриваемом помещении.
| Символы опасности | О,С |
| Описание безопасности | Беречь от тепла, искр и пламени. Надевайте защитную одежду и перчатки. Избегайте контакта с кожей, глазами и одеждой. Не вдыхайте пары. В случае пожара используйте водяной распылитель, пену, сухие химикаты или углекислый газ. |
| Идентификационные номера ООН | ООН2015 |
| код ТН ВЭД | 2847.00.00 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании. Вызывает серьезные ожоги кожи и повреждения глаз. Может вызвать раздражение дыхательных путей. Может вызвать пожар или взрыв. |
Методы синтеза перекиси водорода
Перекись водорода можно синтезировать различными методами, включая антрахиноновый процесс, автоокисление 2-этилантрагидрохинона и электролиз разбавленной серной кислоты . Наиболее распространенным методом промышленного производства перекиси водорода является антрахиноновый процесс.
В антрахиноновом процессе антрахинон сначала гидрируется с образованием антрагидрохинона, который затем окисляется воздухом в присутствии катализатора с образованием перекиси водорода. Затем перекись водорода экстрагируют и очищают с использованием различных методов, таких как дистилляция и фильтрация.
Другой метод синтеза перекиси водорода — автоокисление 2-этилантрагидрохинона. В этом методе 2-этилантрагидрохинон подвергается воздействию воздуха в присутствии щелочного катализатора, который способствует автоокислению соединения с образованием перекиси водорода.
Электролиз разбавленной серной кислоты — еще один метод синтеза перекиси водорода. В этом методе разбавленная серная кислота подвергается электролизу в специальной электролитической ячейке, в которой на одном из электродов образуется перекись водорода.
Пероксид водорода также можно синтезировать другими методами, например, прямым синтезом из водорода и кислорода или восстановлением пероксидов восстановителями. Однако эти методы обычно не используются для коммерческого производства перекиси водорода из-за их низкой эффективности и безопасности.
Использование перекиси водорода
Перекись водорода – универсальное химическое соединение, имеющее широкий спектр применения в различных отраслях промышленности. Вот некоторые распространенные способы применения перекиси водорода:
- В текстильной, бумажной и целлюлозной промышленности H2O2 обычно используется в качестве отбеливателя для удаления цвета с тканей и целлюлозы.
- Медицинские учреждения используют H2O2 в качестве эффективного дезинфицирующего средства для уничтожения бактерий, вирусов и грибков, а также для стерилизации медицинского оборудования и поверхностей.
- На водоочистных станциях H2O2 используется для удаления примесей, таких как железо и марганец, и для дезинфекции воды.
- В красках для волос и продуктах для отбеливания зубов используется H2O2, чтобы осветлить цвет волос и зубов.
- Аэрокосмическая промышленность использует H2O2 в качестве ракетного топлива.
- Производство различных полимеров, таких как полипропилен, полиэтилен и полистирол, предполагает использование H2O2.
- H2O2 — чистящее средство, используемое для удаления пятен и грязи с поверхностей и очистки контактных линз.
- H2O2 используется в пищевой промышленности в качестве отбеливателя и консерванта пищевых продуктов.
В целом, универсальность H2O2 делает его ценным химическим соединением, имеющим множество применений в различных отраслях промышленности.
Вопросы:
Цена перекиси водорода
Цена на перекись водорода может широко варьироваться в зависимости от различных факторов, таких как чистота, концентрация и покупаемое количество. В целом, цена на перекись водорода может варьироваться от копеек за фунт перекиси водорода технической чистоты до нескольких долларов за фунт перекиси высокой чистоты, используемой в специальных целях.
По состоянию на февраль 2023 года средняя цена 35% пищевой перекиси водорода составляла примерно от 20 до 30 долларов за галлон или от 0,10 до 0,20 доллара за жидкую унцию. Перекись водорода промышленного качества с более низкой чистотой и концентрацией может стоить дешевле, обычно от 1 до 5 долларов за галлон. Однако цены могут варьироваться в зависимости от поставщика, региона и других факторов.
Где купить перекись водорода?
Перекись водорода — это распространенное химическое соединение, которое можно приобрести у различных поставщиков, как в Интернете, так и в обычных магазинах. Вот несколько мест, где можно купить перекись водорода:
- Поставщики химикатов. Поставщики химикатов, такие как Sigma-Aldrich, Fisher Scientific и VWR International, предлагают широкий спектр марок и концентраций перекиси водорода для различных применений.
- Интернет-торговые площадки. Интернет-торговые площадки, такие как Amazon, eBay и Alibaba, предлагают перекись водорода от разных поставщиков, разного качества и концентрации.
- Продуктовые магазины и аптеки. Многие продуктовые магазины и аптеки продают перекись водорода низкой концентрации (от 3% до 6%) в качестве антисептика для очистки ран и оказания первой помощи.
- Магазины товаров для бассейнов: перекись водорода можно использовать в качестве окислителя для бассейнов и спа-центров для поддержания прозрачности и дезинфекции воды. В магазинах товаров для бассейнов, таких как Leslie’s Pool Supplies, для этой цели могут продаваться продукты с перекисью водорода.
