Оксид никеля(II) представляет собой химическое соединение формулы NiO. Это черное твердое вещество, обычно используемое в качестве катализатора, а также при производстве керамики и пигментов.
| Название ИЮПАК | Оксид никеля(II) |
| Молекулярная формула | НиО |
| Количество CAS | 1313-99-1 |
| Синонимы | Оксид никеля, монооксид никеля, оксид Ni(II) |
| ИнЧИ | ИнЧИ=1S/Ni.O |
Свойства оксида никеля(II)
Формула оксида никеля(II)
Химическая формула оксида никеля — NiO. Он состоит из одного атома никеля (Ni) и одного атома кислорода (O), что приводит к простой и понятной формуле.
оксид никеля(II) Молярная масса
Молярную массу монооксида никеля можно рассчитать путем сложения атомных масс составляющих его элементов. Для NiO молярная масса составляет примерно 74,69 грамма на моль (г/моль).
Температура кипения оксида никеля(II)
Моноксид никеля не имеет четкой точки кипения, поскольку он подвергается разложению до достижения точки кипения. При нагревании он распадается на составные элементы: никель и кислород.
Оксид никеля(II) Температура плавления
Температура плавления монооксида никеля составляет примерно 1984 градуса Цельсия (1984 °C). При этой температуре твердый NiO переходит в жидкое состояние.
Плотность оксида никеля(II), г/мл
Плотность монооксида никеля составляет примерно 6,67 грамма на миллилитр (г/мл). Это значение указывает количество массы, упакованной в данный объем, что делает его мерой компактности вещества.
Оксид никеля(II) Молекулярный вес
Молекулярная масса монооксида никеля рассчитывается путем сложения атомных масс составляющих его элементов. Молекулярная масса NiO составляет примерно 74,69 грамма на моль (г/моль).
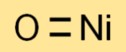
Строение оксида никеля(II)
Моноксид никеля имеет кубическую кристаллическую структуру. Он состоит из ионов никеля (Ni2+) и ионов оксида (O2-), расположенных в регулярном, повторяющемся порядке. Эта структура способствует его характерным свойствам и поведению.
Растворимость оксида никеля(II)
Окись никеля плохо растворяется в воде. Он имеет ограниченную растворимость, то есть растворяется в воде лишь в небольшой степени. Однако он может реагировать с кислотами с образованием растворимых солей никеля, проявляя определенную степень химической активности.
| Появление | Сплошной черный |
| Удельный вес | 6,67 г/мл |
| Цвет | Черный |
| Запах | Без запаха |
| Молярная масса | 74,69 г/моль |
| Плотность | 6,67 г/мл |
| Точка плавления | 1984°С |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Плохо растворим |
| Растворимость | Растворим в кислотах, образует растворимые соли никеля. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Непригодный |
| рН | Нейтральный |
Обратите внимание, что некоторые свойства, такие как температура вспышки, давление паров и pKa, неприменимы или недоступны для монооксида никеля.
Безопасность и опасность оксида никеля (ii)
Моноксид никеля представляет определенные соображения безопасности и опасности. Важно обращаться с ним осторожно. Следует избегать прямого контакта с кожей, глазами или вдыхания его пыли или паров. У некоторых людей это может вызвать раздражение кожи и аллергические реакции. При проглатывании или вдыхании требуется немедленная медицинская помощь. Оксид никеля не считается легковоспламеняющимся, но может способствовать возгоранию при контакте с горючими материалами. Важно хранить и обращаться с ним в хорошо проветриваемом помещении. При работе с монооксидом никеля следует носить соответствующие средства индивидуальной защиты, такие как перчатки и очки, чтобы свести к минимуму потенциальные риски.
| Символы опасности | Никто |
| Описание безопасности | Обращаться осторожно. Избегайте прямого контакта и вдыхания. Используйте соответствующее защитное оборудование. При необходимости обратитесь за медицинской помощью. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2825.70.10 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Неклассифицированный |
| Токсичность | Считается вредным при проглатывании или вдыхании. Может вызвать раздражение кожи и аллергические реакции. |
Обратите внимание, что монооксид никеля не имеет конкретных символов опасности, идентификаторов ООН, класса опасности или группы упаковки. Предоставленная информация по безопасности основана на общих знаниях и мерах предосторожности, связанных с обращением и использованием монооксида никеля. Для получения точной и подробной информации важно обращаться к специальным паспортам безопасности (SDS) и следовать рекомендуемым мерам безопасности.
Методы синтеза оксида никеля(ii)
Существует несколько методов синтеза монооксида никеля. Распространенным подходом является термическое разложение соединений никеля, таких как карбонат никеля или гидроксид никеля. В этом методе нагревание конкретного соединения-предшественника в отсутствие кислорода с образованием монооксида никеля.
Другой метод предполагает окисление металлического никеля. Металлический никель может реагировать с кислородом или воздухом при высоких температурах с образованием монооксида никеля. Выполните этот процесс путем прокаливания или обжига металлического никеля в атмосфере воздуха или кислорода для получения монооксида никеля.
Используйте реакции осаждения для синтеза монооксида никеля путем взаимодействия солей никеля, таких как хлорид никеля или нитрат никеля, с щелочным раствором, таким как гидроксид натрия или гидроксид аммония . В результате этой реакции образуется осадок монооксида никеля.
Золь-гель синтез — еще один жизнеспособный метод. Это включает гидролиз и конденсацию подходящих предшественников никеля, таких как алкоксиды никеля, в растворе. Моноксид никеля получают путем сушки и прокаливания геля, образующегося в ходе реакции осаждения.
Используйте методы электроосаждения для синтеза монооксида никеля. При подаче электрического тока на никелевый электрод, погруженный в раствор электролита, на поверхности электрода может образоваться окись никеля.
При выборе метода синтеза следует учитывать такие факторы, как желаемая чистота, масштабируемость и конкретные требования применения, поскольку каждый метод предлагает свои преимущества.
Использование оксида никеля(ii)
Моноксид никеля благодаря своим уникальным свойствам находит разнообразное применение в различных отраслях промышленности. Вот некоторые из его распространенных применений:
- Катализатор: монооксид никеля активно катализирует различные химические реакции, такие как процессы гидрирования и окисления, способствуя превращению реагентов в желаемые продукты.
- Керамика: при производстве керамических материалов монооксид никеля активно действует как краситель, активно способствуя достижению определенных цветов и узоров в керамических глазурях и пигментах.
- Аккумуляторы. В перезаряжаемых никель-кадмиевых (NiCd) и никель-металлогидридных (NiMH) батареях активно используется монооксид никеля в качестве материала положительного электрода, активно обеспечивающего хранение и высвобождение электрической энергии.
- Датчики газа: оксид никеля активно обнаруживает такие газы, как оксид углерода (CO) и диоксид азота (NO2), в приложениях для обнаружения газа при использовании в датчиках на его основе.
- Производство стекла: Стекольная промышленность активно использует монооксид никеля для придания различных цветов стекольным изделиям, тем самым активно способствуя производству цветного стекла, в том числе зеленого, коричневого и черного оттенков.
- Проводящие покрытия. Моноксид никеля активно действует как компонент проводящих покрытий, которые при нанесении на них делают такие материалы, как стекло или пластик, активно проводящими.
- Топливные элементы: монооксид никеля активно действует как компонент твердооксидных топливных элементов (ТОТЭ), активно выступая в качестве катодного материала и участвуя в электрохимических реакциях внутри топливного элемента.
- Поддержка катализатора: монооксид никеля активно служит материалом поддержки для других катализаторов, активно улучшая их стабильность и производительность.
Разнообразный спектр применения монооксида никеля подчеркивает его важность в различных отраслях промышленности, подчеркивая его полезность и универсальность.
Вопросы:
Вопрос: Какова формула оксида никеля (II)?
Ответ: Формула оксида никеля(II) — NiO.
Вопрос: Какая соль образуется при взаимодействии оксида никеля(II) с азотной кислотой?
A: Реакция оксида никеля(II) с азотной кислотой образует нитрат никеля(II) (Ni(NO3)2).
Вопрос: При каком напряжении никель(II) окисляется до никеля(III)?
A: Никель(II) окисляется до никеля(III) при напряжении примерно +1,63 В.
Вопрос: Что происходит, когда Ni(s) окисляется до иона никеля(II), как показано на рисунке?
Ответ: Во время окисления Ni(s) до иона никеля(II) электроны теряются, что приводит к образованию ионов Ni2+.
Вопрос: Какие массы оксида никеля(II) и алюминия нужно использовать для получения 13,3 г никеля?
Ответ: Массы оксида никеля(II) и алюминия, необходимые для получения 13,3 г никеля, зависят от конкретной реакции и стехиометрии.
