Хлорид натрия (NaCl) представляет собой соединение, состоящее из ионов натрия и хлора. Ее обычно называют поваренной солью, и ее используют для приправы и консервирования пищевых продуктов.
| Название ИЮПАК | Хлорид натрия |
| Молекулярная формула | NaCl |
| Количество CAS | 7647-14-5 |
| Синонимы | Галит, каменная соль, солевой раствор, морская соль |
| ИнЧИ | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Формула хлорида натрия
Химическая формула хлорида натрия — NaCl, представляющая собой комбинацию ионов натрия (Na+) и ионов хлорида (Cl-). Формула указывает относительное количество атомов или ионов в соединении, что позволяет легко идентифицировать и представить его состав.
Молярная масса of NaCl
Молярная масса хлорида натрия, также называемого поваренной солью, составляет 58,44 г/моль. Это означает, что в одном моле хлорида натрия содержится 58,44 грамма соединения. Молярная масса рассчитывается путем сложения атомных масс натрия (Na) и хлора (Cl) в соединении, которые составляют 22,99 г/моль и 35,45 г/моль соответственно.
Температура кипения хлорида натрия
Хлорид натрия имеет высокую температуру кипения 1413 ° C (2575 ° F) из-за своей ионной связи. При нагревании подводимая энергия разрывает ионные связи между ионами натрия и хлорида, в результате чего соединение переходит из твердого состояния в жидкое. Температура кипения хлорида натрия выше, чем у многих других соединений, из-за сильного электростатического притяжения между ионами.
Температура плавления хлорида натрия
Температура плавления хлорида натрия составляет 801°C (1474°F). Как и температура кипения, высокая температура плавления обусловлена прочными ионными связями между ионами натрия и хлорида. При нагревании подводимая энергия преодолевает электростатические силы, которые удерживают ионы вместе, вызывая переход соединения из твердого состояния в жидкое.
Плотность хлорида натрия г/мл
Плотность хлорида натрия составляет 2,165 г/мл при комнатной температуре (25°C или 77°F). Плотность – это мера массы единицы объема вещества. Высокая плотность хлорида натрия обусловлена компактным расположением его атомов и прочной ионной связью между ионами натрия и хлорида.
Молекулярный вес хлорида натрия
Молекулярная масса хлорида натрия, как упоминалось ранее, составляет 58,44 г/моль. Молекулярная масса рассчитывается путем сложения атомных весов всех атомов молекулы. Хотя хлорид натрия не существует в виде молекулы в традиционном понимании, его молекулярная масса рассчитывается на основе формульной единицы NaCl.
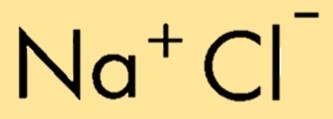
Структура хлорида натрия
Хлорид натрия имеет кристаллическую структуру, состоящую из регулярного расположения ионов натрия и хлорида в соотношении 1:1. Структура представляет собой гранецентрированную кубическую решетку, в которой каждый ион натрия окружен шестью ионами хлорида, а каждый ион хлорида — шестью ионами натрия. Ионная связь в хлориде натрия приводит к образованию сетчатой структуры, которая очень стабильна и ее трудно разорвать.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2.165 |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 58,44 г/моль |
| Плотность | 2,165 г/мл |
| Точка плавления | 801°С (1474°Ф) |
| Точка кипения | 1413°C (2575°F) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 359 г/л при 20°C |
| Растворимость | Растворим в воде и глицерине; нерастворим в этаноле и ацетоне |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | 7 |
| рН | 7 (нейтральный) |
Безопасность и опасность хлорида натрия
Хлорид натрия (NaCl) обычно считается безопасным для потребления и использования человеком. Однако воздействие высоких концентраций NaCl может вызвать раздражение глаз, кожи и дыхательных путей. Проглатывание большого количества NaCl может привести к обезвоживанию, электролитному дисбалансу и даже смерти. Хлорид натрия также может представлять опасность пожара и взрыва при контакте с горючими материалами. Во избежание несчастных случаев необходимо правильное обращение и хранение. Важно следовать надлежащим рекомендациям и мерам безопасности при обращении и использовании NaCl, чтобы свести к минимуму риск повреждения.
| Символы опасности | Никто |
| Описание безопасности | Вреден при проглатывании или вдыхании. Вызывает раздражение кожи и глаз. |
| Идентификационные номера ООН | ООН 7646 |
| код ТН ВЭД | 2501.00.90 |
| Класс опасности | Нетоксичный |
| Группа упаковки | Непригодный |
| Токсичность | LD50 (перорально, крыса) – 3000 мг/кг |
Методы синтеза хлорида натрия
Хлорид натрия можно получить из различных источников, включая соляные шахты и морскую воду, но его также можно синтезировать в лаборатории посредством химических реакций.
Обычный метод синтеза хлорида натрия включает взаимодействие соляной кислоты (HCl) и гидроксида натрия (NaOH) . В результате этой реакции в качестве побочных продуктов образуются хлорид натрия и вода. Уравнение этой реакции:
HCl + NaOH → NaCl + H2O
Другой метод включает реакцию карбоната натрия (Na2CO3) с соляной кислотой (HCl) с образованием хлорида натрия, диоксида углерода и воды. Уравнение этой реакции:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
Реакция между натрием и газообразным хлором является одним из таких методов синтеза хлорида натрия. Эта реакция требует высоких температур и тщательного контроля во избежание образования нежелательных побочных продуктов. Уравнение этой реакции:
2Na + Cl2 → 2NaCl
Химики могут модифицировать или варьировать методы синтеза хлорида натрия в зависимости от таких факторов, как стоимость, доступность реагентов, а также желаемая чистота и выход конечного продукта. Эти методы обеспечивают производство хлорида натрия, даже если природные источники редки.
Использование хлорида натрия
Хлорид натрия, также известный как поваренная соль, находит широкое применение в различных отраслях промышленности и применениях. Некоторые из распространенных применений хлорида натрия:
- Пищевая промышленность: используется в качестве приправы и усилителя вкуса в различных пищевых продуктах, включая снеки, мясные полуфабрикаты и выпечку.
- Медицинская промышленность: используется во внутривенных растворах и других медицинских процедурах для пополнения жидкости и электролитов в организме.
- Химическая промышленность: используется при производстве различных химикатов, в том числе хлора, гидроксида натрия и карбоната натрия.
- Очистка воды: используется при очистке воды для удаления примесей и придания ей пригодности для питья.
- Сельское хозяйство: используется в качестве удобрения для сельскохозяйственных культур, особенно в районах, где в почве не хватает необходимых питательных веществ.
- Противообледенительное средство: используется в качестве противообледенительного средства на дорогах и тротуарах зимой для предотвращения несчастных случаев на скользких поверхностях.
- Текстильная промышленность: используется при производстве синтетических волокон, таких как нейлон и полиэстер.
- Нефтяная и газовая промышленность: используется при бурении и добыче нефти и газа.
- Животноводство: используется в качестве пищевой добавки для скота, способствующей здоровому росту и развитию.
Это всего лишь несколько примеров широкого применения хлорида натрия. Его универсальность и доступность делают его важным ингредиентом во многих продуктах и процессах в самых разных отраслях.
Вопросы:
Вопрос: Является ли хлорид натрия соединением?
Ответ: Да, хлорид натрия — это соединение.
Вопрос: Является ли хлорид натрия ионным или ковалентным?
Ответ: Хлорид натрия является ионным соединением.
Вопрос: Что такое хлорид натрия?
Ответ: Хлорид натрия представляет собой белое кристаллическое соединение с химической формулой NaCl. Ее обычно называют поваренной солью, и она необходима для питания человека и животных.
Вопрос: Для чего используется хлорид натрия?
Ответ: Хлорид натрия широко используется в различных отраслях промышленности и применениях, в том числе в качестве приправы и усилителя вкуса пищевых продуктов, в медицинских целях, в химическом производстве, при очистке воды, в качестве антиобледенительного средства, в текстиле и нефти. и газ, а также в качестве кормовой добавки для скота.
Вопрос: Растворяется ли хлорид натрия в воде?
Ответ: Да, хлорид натрия хорошо растворим в воде.
