Муравьиная кислота или HCOOH представляет собой бесцветную жидкость с резким запахом. Он широко используется в качестве консерванта и антибактериального средства, а также при производстве кожи, текстиля и резины.
| Название ИЮПАК | Метановая кислота |
| Молекулярная формула | HCOOH |
| Количество CAS | 64-18-6 |
| Синонимы | Водородная карбоновая кислота, формиловая кислота, аминокислота, формиловая кислота, метакарбоновая кислота, тионилмуравьиная кислота и т. д. |
| ИнЧИ | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
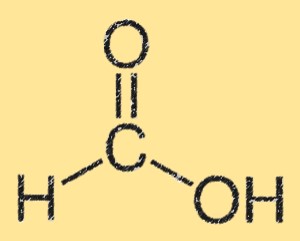
Структура муравьиной кислоты
Структура муравьиной кислоты характеризуется наличием группы карбоновой кислоты (-СООН), присоединенной к одному атому углерода. Атом углерода также связан с атомом водорода и атомом кислорода. Структура муравьиной кислоты плоская и имеет водородные связи между группами карбоновой кислоты. Водородная связь обуславливает его высокую растворимость в воде.
Формула муравьиной кислоты
Химическая формула муравьиной кислоты – HCOOH. Это простое органическое соединение, содержащее один атом углерода, один атом кислорода и два атома водорода. Формула муравьиной кислоты важна при определении ее химических и физических свойств, а также поведения в различных условиях. Он также используется в различных химических расчетах, таких как стехиометрия и молярность.
Структура Льюиса HCOOH
Структура Льюиса муравьиной кислоты (HCOOH) выглядит следующим образом:
ЧАС
|
С=О
|
ОЙ
Атом углерода находится в центре структуры с четырьмя валентными электронами. Он образует одинарные связи с двумя атомами водорода и атомом кислорода, имеющим две пары свободных электронов. Атом кислорода также образует двойную связь с другим атомом углерода, который несет пару свободных электронов. Структура Льюиса показывает, что молекула имеет полярную ковалентную связь из-за разницы в электроотрицательности между атомами углерода и кислорода.
Муравьиная кислота Молярная масса
Молярная масса муравьиной кислоты, также называемой метановой кислотой, составляет 46,03 г/моль. Его химическая формула — HCOOH, что указывает на то, что он содержит один атом углерода, один атом кислорода и два атома водорода. Молярная масса — важный параметр для определения количества вещества, необходимого для приготовления раствора определенной концентрации. Например, для приготовления 1 М раствора муравьиной кислоты необходимо растворить 46,03 г муравьиной кислоты в 1 л растворителя.
Температура кипения муравьиной кислоты
Температура кипения HCOOH составляет 100,8°C (213,4°F). Это бесцветная жидкость с резким запахом, хорошо растворимая в воде. Температура кипения HCOOH относительно низкая, что означает, что его можно легко испарить и перегнать. Это свойство делает его полезным в различных отраслях промышленности, таких как производство красителей, пластмасс и фармацевтических препаратов.
HCOOH Точка плавления
Температура плавления HCOOH составляет 8,4°C (47,1°F). При комнатной температуре он представляет собой твердое вещество, и его можно получить в чистом виде, охладив его ниже температуры плавления. Кристаллы HCOOH имеют белый цвет и издают резкий запах. Температура плавления HCOOH относительно низкая по сравнению с другими карбоновыми кислотами, что делает ее полезным растворителем для некоторых химических реакций.
HCOOH Плотность г/мл
Плотность HCOOH составляет 1220 г/мл при 25°C (77°F). Он плотнее воды, плотность которой при той же температуре составляет 1000 г/мл. Плотность HCOOH — важное свойство, определяющее его растворимость в воде и других растворителях. Это также влияет на его поведение в различных условиях, таких как температура и давление.
Молекулярный вес муравьиной кислоты
Молекулярная масса муравьиной кислоты составляет 46,03 г/моль. Это простое органическое соединение с химической формулой HCOOH. Молекулярная масса – важный параметр, определяющий физические и химические свойства вещества. Он используется для расчета различных величин, таких как количество молей, масса и объем вещества.
| Появление | Бесцветная жидкость |
| Удельный вес | 1.22 |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 46,03 г/моль |
| Плотность | 1220 г/мл |
| Точка плавления | 8,4°С |
| Точка кипения | 100,8°С |
| Мигающая точка | 68°С |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в большинстве органических растворителей. |
| Давление газа | 44,5 мм рт.ст. |
| Плотность пара | 1,5 (воздух=1) |
| пКа | 3,75 |
| рН | 2.4 |
Безопасность и опасность муравьиной кислоты
HCOOH представляет собой ряд рисков для безопасности и опасностей. Это очень едкое и токсичное вещество, которое при попадании может вызвать серьезные ожоги кожи и повреждения глаз. Вдыхание паров HCOOH может вызвать раздражение дыхательных путей и повреждение легких. Он также легко воспламеняется и может воспламениться при высоких температурах, создавая опасность пожара. При обращении с HCOOH следует принимать соответствующие меры предосторожности, включая использование защитной одежды, перчаток и средств защиты глаз. Его следует хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых материалов, таких как окислители и щелочи.
| Символы опасности | Коррозионный, Токсичный |
| Описание безопасности | Надевайте защитные перчатки и средства защиты глаз/лица. При попадании в глаза немедленно промыть большим количеством воды и промыть врачу. |
| Идентификационные номера ООН | ООН1779 |
| код ТН ВЭД | 2915.11.00 |
| Класс опасности | 8 (Коррозионный) |
| Группа упаковки | II (средний уровень) |
| Токсичность | LD50 1,8 г/кг (перорально, крыса) |
Методы синтеза муравьиной кислоты
Муравьиную кислоту можно синтезировать различными методами.
- Распространенный метод включает реакцию монооксида углерода и воды в присутствии катализатора, такого как родий или кобальт. Это процесс Формокс. В результате этого процесса образуется муравьиная кислота и газообразный водород.
- Другой метод включает окисление формальдегида сильным окислителем, например хромовой кислотой или перманганатом калия, в кислых условиях. В результате этой реакции образуется муравьиная кислота и вода.
- Одним из способов синтеза муравьиной кислоты является взаимодействие формиата натрия с серной кислотой. Эта реакция приводит к образованию муравьиной кислоты и сульфата натрия в качестве побочного продукта.
- Муравьи производят муравьиную кислоту в качестве естественного защитного механизма, и ее можно получить из тела путем перегонки.
- Другой метод синтеза HCOOH включает реакцию углекислого газа с водородом в присутствии катализатора, такого как хромит меди или оксид цинка. Этот процесс, известный как реакция синтеза HCOOH, приводит к образованию HCOOH и воды.
- HCOOH также можно получить из природных источников, таких как листья крапивы, где он присутствует в небольших количествах.
В целом существует несколько методов синтеза HCOOH, каждый из которых имеет свои преимущества и недостатки.
Использование муравьиной кислоты
Муравьиная кислота имеет широкий спектр применения в различных отраслях промышленности.
- Ее способность предотвращать рост вредных микроорганизмов делает муравьиную кислоту распространенным выбором в качестве консерванта и антибактериального средства в кормах для животных и силосе.
- Он помогает предотвратить рост вредных микроорганизмов в кормах и силосе, что делает его полезной добавкой.
- Текстильная промышленность использует муравьиную кислоту в качестве средства для окраски и отделки тканей, чтобы улучшить стойкость цвета и увеличить сродство красителей к волокнам.
- Муравьиная кислота служит растворителем и промежуточным продуктом в производстве различных химикатов, таких как уксусная кислота, формамид и метанол.
- Муравьиная кислота — это дубильный агент, используемый в кожевенной промышленности, который помогает улучшить текстуру и долговечность кожаных изделий.
- В производстве каучука муравьиная кислота способствует процессу вулканизации, выступая в качестве коагулянта.
- Фармацевтическая промышленность использует муравьиную кислоту в качестве консерванта для вакцин и дезинфицирующего средства для медицинского оборудования.
- Кроме того, муравьиная кислота находит применение при производстве различных лекарств, в том числе диуретиков и антигистаминных средств.
- Муравьиная кислота является восстановителем в реакциях органического синтеза и катализатором в реакциях полимеризации.
- Муравьиная кислота помогает усилить аромат различных продуктов, что делает ее полезной при производстве ароматизаторов и ароматизаторов.
В целом разнообразие применения муравьиной кислоты в различных отраслях промышленности обусловлено ее уникальными свойствами и универсальностью.
Вопросы:
Вопрос. Является ли муравьиная кислота сильной кислотой?
А. Муравьиная кислота — слабая кислота со значением pKa примерно 3,75. Это означает, что он не диссоциирует полностью в воде и является более слабой кислотой, чем сильные кислоты, такие как соляная кислота или серная кислота.
Вопрос. Какая кислота более кислая: муравьиная или уксусная?
А. Муравьиная кислота более кислая, чем уксусная. Это связано с наличием в уксусной кислоте метильной группы, которая стабилизирует отрицательный заряд сопряженного основания, что снижает вероятность его диссоциации. С другой стороны, муравьиная кислота имеет меньший размер молекулы и более сильный электроотрицательный атом (кислород), что облегчает ее диссоциацию и делает ее более кислой.
Вопрос. Какой муравей производит муравьиную кислоту?
А. Муравьиная кислота вырабатывается несколькими видами муравьев, в том числе древесными, огненными муравьями и некоторыми видами безжалостных пчел. Кислота хранится в организме муравья и используется в качестве защитного механизма от хищников. При угрозе муравей может выстрелить муравьиной кислотой из своего жала или выпустить ее из специальных желез своего тела.
