Карбид кальция — химическое соединение формулы CaC2. В основном он используется для производства газообразного ацетилена и цианамида кальция. Он реагирует с водой с образованием газообразного ацетилена и гидроксида кальция. Люди используют его для сварки и освещения.
| Название ИЮПАК | Этинедиид кальция |
| Молекулярная формула | СаС2 |
| Количество CAS | 75-20-7 |
| Синонимы | Ацетилид кальция, перуглерод кальция, дикарбид кальция, карбюро кальция, карбюрокальцико, этинедиид кальция |
| ИнЧИ | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Свойства карбида кальция
Формула карбида кальция
Химическая формула карбида кальция — CaC2. Это означает, что молекула карбида кальция состоит из одного атома кальция и двух атомов углерода. Формула показывает соотношение элементов соединения.
карбид кальция Молярная масса
Молярная масса CaC2 составляет 64,099 г/моль. Это означает, что один моль CaC2 имеет массу 64 099 граммов. Молярная масса рассчитывается путем сложения атомных масс элементов в формуле. Атомная масса кальция составляет 40,078 г/моль, углерода — 12,011 г/моль.
Температура кипения карбида кальция
Температура кипения CaC2 составляет 2300°С. Это означает, что при этой температуре CaC2 переходит из жидкого состояния в газообразное. На температуру кипения влияют межмолекулярные силы и атмосферное давление. CaC2 имеет прочные ионные связи, для разрыва которых требуется много энергии.
Карбид кальция Температура плавления
Температура плавления CaC2 составляет 2160°С. Это означает, что при этой температуре CaC2 переходит из твердого состояния в жидкое. На температуру плавления также влияют межмолекулярные силы и атмосферное давление. CaC2 имеет высокую температуру плавления из-за сильных ионных связей.
Плотность карбида кальция г/мл
Плотность CaC2 составляет 2,22 г/мл. Это означает, что один миллилитр CaC2 имеет массу 2,22 грамма. Плотность рассчитывается путем деления массы на объем. Плотность зависит от конфигурации и расположения атомов или молекул в веществе. CaC2 имеет высокую плотность, поскольку его атомы плотно упакованы вместе в кристаллической структуре.
Карбид кальция Молекулярный вес
Молекулярная масса CaC2 составляет 64 099 а.е.м. (атомные единицы массы). Это означает, что молекула CaC2 имеет массу 64 099 а.е.м. Молекулярная масса рассчитывается путем умножения атомных масс элементов в формуле на соответствующее количество атомов. Атомная масса кальция составляет 40,078 а.е.м., углерода — 12,011 а.е.м.
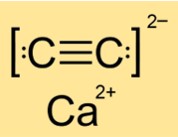
Структура карбида кальция
Строение CaC2 тетрагональное, моноклинное или моноклинное в зависимости от фазы (I, II или III). Это означает, что CaC2 имеет разную форму и расположение атомов или молекул в разных состояниях или условиях. Структура определяется симметрией и геометрией вещества. CaC2 имеет тетрагональную структуру в фазе I, моноклинную структуру в фазе II и еще одну моноклинную структуру в фазе III.
Растворимость карбида кальция
Растворимость CaC2 заключается в быстром гидролизе в воде. Это означает, что CaC2 быстро реагирует с водой и образует в качестве продуктов газообразный ацетилен и гидроксид кальция. Растворимость измеряется количеством вещества, которое может раствориться в данном растворителе при данной температуре и давлении. Растворимость зависит от природы и полярности вещества и растворителя, а также от других факторов, таких как pH и соленость.
| Появление | Белый порошок с серыми/черными кристаллами или бесцветное кристаллическое вещество 3 |
| Удельная плотность | 2.22 |
| Цвет | Бесцветный (чистый) или серый/коричневый (техническое качество) |
| Запах | Без запаха (чистый) или чесночный (технический сорт) |
| Молярная масса | 64 099 г/моль |
| Плотность | 2,22 г/см3 |
| Точка плавления | 2160°С |
| Точка кипения | 2300°С |
| Мигающая точка | 305°С (ацетилен) |
| Растворимость в воде | Быстрый гидролиз |
| Растворимость | Нерастворим в этаноле и эфире. |
| Давление газа | Незначительный |
| Плотность пара | 2,21 (ацетилен) |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность карбида кальция
CaC2 — легковоспламеняющееся и опасное химическое вещество. При контакте с водой или влажностью может возникнуть опасность пожара и взрыва. Он выделяет газ ацетилен, который также является легковоспламеняющимся и взрывоопасным. CaC2 также может нанести вред вашему здоровью. Это может вызвать раздражение кожи, глаз и легких. Это может вызвать сыпь, повреждение глаз, кашель и одышку. Это также может привести к скоплению жидкости в легких, если вы вдыхаете большое количество жидкости. Вам следует избегать контакта с CaC2 и носить защитное снаряжение при работе с ним. Также следует хранить его в сухом закрытом контейнере, вдали от источников возгорания.
| Символы опасности | F (легковоспламеняющийся), C (коррозионный), W (реагирует с водой) |
| Описание безопасности | S2 (хранить в недоступном для детей месте), S7/8 (держать контейнер плотно закрытым и сухим), S16 (держать вдали от источников возгорания), S26 (при попадании в глаза немедленно промыть большим количеством воды и обратиться за медицинской помощью). рекомендации), S36/37/39 (надевайте подходящую защитную одежду, перчатки и средства защиты глаз/лица), S43 (в случае пожара используйте сухой песок или сухой химический порошок), S45 (в случае несчастного случая или дискомфорта обратитесь немедленная медицинская консультация) |
| Идентификационные номера ООН | ООН 1402 |
| код ТН ВЭД | 28491000 |
| Класс опасности | 4.3 |
| Группа упаковки | я |
| Токсичность | Перорально LD50, крыса: 80 мг/кг, LC50, ингаляционно, крыса: 1000 ppm/4 часа. |
Методы синтеза карбида кальция.
Существуют различные методы синтеза CaC2 из источников кальция и оксида углерода.
Одним из наиболее распространенных методов является метод электродуговой печи. В этом процессе электрическая дуга нагревает смесь извести и кокса примерно до 2200°C. Реакция эндотермическая и приводит к образованию расплавленного CaC2 и монооксида углерода. После плавления CaC2 охлаждается, и люди измельчают его на куски или в порошок, в зависимости от предполагаемого использования. Этот метод имеет высокие энергозатраты и стоимость оборудования.
Другой метод — твердотельный метод. Чтобы выполнить этот метод, нагрейте смесь оксида кальция и биоугля или древесного угля, полученного из биомассы, в духовке примерно до 1750°C. Реакция протекает твердо-твердо и приводит к образованию твердого CaC2 и монооксида углерода. Вы можете напрямую использовать или дополнительно обрабатывать твердый CaC2. Этот метод имеет меньшие энергозатраты и стоимость оборудования, чем метод электродуговой печи.
Третий метод – это метод замещения качества энергии угольного кокса. Для проведения процесса смешивают низкосортный уголь и известь , формируют окатыши, затем пиролизуют их в печи при температуре 1000°С. Произведенный газ генерирует электричество, а горячие пеллеты передаются в печь CaC2 при температуре 2000°C. Реакция протекает твердо-твердо и приводит к образованию расплавленного CaC2 и монооксида углерода. После охлаждения расплавленный CaC2 подвергается измельчению с образованием комков или порошка. Этот метод имеет более высокую энергоэффективность и использование ресурсов, чем метод электродуговой печи.
Использование карбида кальция
- Когда CaC2 реагирует с водой, образуется газообразный ацетилен и гидроксид кальция. Газообразный ацетилен является важным промежуточным продуктом для синтеза многих органических химикатов и полимеров, таких как поливинилхлорид, винилацетат, 1,4-бутандиол и т. д. Гидроксид кальция — универсальное соединение, имеющее множество применений.
- Чтобы получить цианамид кальция, люди реагируют CaC2 с азотом при высоких температурах. Цианамид кальция действует как азотное удобрение, гербицид и дефолиант.
- Для снижения содержания серы в железе, чугуне, чугуне и стали применяют СаС2. Это химическое соединение реагирует с серой с образованием сульфида кальция, эффективно обессеривая металл. Этот процесс повышает качество и пластичность стальной продукции.
- Карбидные лампы используют CaC2 для производства газообразного ацетилена, который при горении генерирует свет. Эти лампы были популярны в горнодобывающей, спелеологической, велосипедной и автомобильной промышленности до того, как электрические лампы стали обычным явлением.
- Люди используют CaC2 в качестве агента созревания таких фруктов, как бананы, манго и папайя. Он выделяет газ этилен, который ускоряет процесс созревания и усиливает цвет и сладость фруктов. Многие страны считают практику использования остатков CaC2 для дозревания фруктов незаконной и вредной из-за связанных с этим рисков для здоровья.
- Люди используют CaC2 в бамбуковых пушках и пушках большого взрыва, чтобы издавать громкие звуки. При смешивании с водой образуется газ ацетилен, который воспламеняется, создавая веселье и праздник для всех.
- Также используется в качестве раскислителя в сталеплавильном производстве. Он удаляет кислород из расплавленной стали и предотвращает образование оксидов, которые могут повлиять на качество стальной продукции.
Вопросы:
Вопрос: Где купить карбид кальция на месте?
О: Вы можете найти небольшое количество CaC2 в вашем районе в некоторых магазинах скобяных изделий или сварочных материалов. Однако, если вам нужны большие количества CaC2, лучше всего импортировать его напрямую от производителей. Вы можете связаться с некоторыми поставщиками онлайн.
Вопрос: Как удалить карбид кальция?
Ответ: CaC2 является опасным отходом, и его необходимо утилизировать надлежащим образом. Не следует выбрасывать его в мусор или в канализацию, так как он может вступить в реакцию с водой и образовать газообразный ацетилен, который легко воспламеняется и взрывоопасен. Вам следует обратиться в местный орган по утилизации опасных отходов или в лицензированную компанию по утилизации отходов за советом о том, как безопасно утилизировать CaC2. Возможно, его потребуется нейтрализовать водой в хорошо проветриваемом помещении, а затем упаковать в герметичный контейнер для транспортировки.
Вопрос: Что образуется при реакции карбида кальция с тяжелой водой?
Ответ: Тяжелая вода — это вода, содержащая дейтерий вместо водорода. Дейтерий – это изотоп водорода, имеющий в ядре один протон и один нейтрон. При реакции CaC2 с тяжелой водой образуется гидроксид кальция и дейтерированный ацетилен. Дейтерированный ацетилен — это ацетилен, содержащий дейтерий вместо водорода. Химическое уравнение этой реакции:
СаС2 + 2D2O -> Са(OD)2 + C2D2
Вопрос: Опасен ли карбид кальция?
Ответ: Да, CaC2 опасен, и с ним следует обращаться осторожно. Он может вызвать опасность пожара и взрыва при контакте с водой или влагой, поскольку выделяет газообразный ацетилен, который также является легковоспламеняющимся и взрывоопасным веществом. Это также может нанести вред вашему здоровью, поскольку может раздражать кожу, глаза и легкие. CaC2 может вызывать кожную сыпь, повреждение глаз, кашель и одышку. Это также может привести к скоплению жидкости в легких, если вы вдыхаете большое количество жидкости. Вам следует избегать контакта с CaC2 и носить защитное снаряжение при работе с ним. Также следует хранить его в сухом закрытом контейнере, вдали от источников возгорания.
Вопрос: Карбид кальция ионный или ковалентный?
Ответ: CaC2 — ионное соединение. Он состоит из ионов кальция (Ca2+) и ионов карбида (C22-). Ионные соединения образуются, когда атомы металлов теряют электроны, а атомы неметаллов приобретают электроны для достижения стабильных электронных конфигураций. Образующиеся ионы удерживаются вместе электростатическими силами притяжения. CaC2 имеет прочные ионные связи, для разрыва которых требуется много энергии.
Вопрос: Как производится карбид кальция?
Ответ: CaC2 получают путем нагревания смеси извести (оксида кальция) и кокса (углерода) примерно до 2200°C в электродуговой печи. Реакция эндотермическая и приводит к образованию расплавленного CaC2 и монооксида углерода. Затем расплавленный CaC2 охлаждают и измельчают на куски или в порошок. Этот метод имеет высокие энергозатраты и стоимость оборудования. Существуют также другие методы, в которых используются различные источники углерода, такие как биоуголь или низкосортный уголь, а также различные методы нагрева, такие как твердотельный нагрев или индукционный нагрев. Эти методы могут иметь более низкое энергопотребление и стоимость оборудования, чем метод электродуговой печи.
Вопрос: Могу ли я превратить карбонат кальция в карбид кальция?
Ответ: Нет, вы не можете напрямую преобразовать карбонат кальция в CaC2. Карбонат кальция — стабильное соединение, не вступающее в реакцию с углеродом при высоких температурах. Карбонат кальция необходимо сначала превратить в оксид кальция путем сильного нагревания в отсутствие воздуха (прокаливания). Затем вы можете вступить в реакцию оксида кальция с углеродом при высоких температурах с образованием CaC2 (науглероживание). Общее химическое уравнение этого процесса:
СаСО3 -> СаО + СО2
СаО + 3С -> СаС2 + СО
Вопрос: Что верно в отношении следующей реакции? Ca(тв) + 2C(тв) -> CaC2(тв) + 62,8 кДж
Ответ: Для реакции верны следующие утверждения:
- Это синтетическая реакция, в которой два или более элементов соединяются с образованием соединения.
- Это экзотермическая реакция, при которой тепло выделяется в окружающую среду.
- Это окислительно-восстановительная реакция, при которой кальций окисляется, а углерод восстанавливается.
- Это обратная реакция образования CaC2 из оксида кальция и углерода.
Вопрос: Какова стандартная теплота образования cac2(s)?
Ответ: Стандартная теплота образования cac2(s) — это изменение энтальпии, когда один моль CaC2 образуется из его элементов в их стандартных состояниях при 25°C и 1 атм. Его можно рассчитать по приведенным термохимическим уравнениям, используя закон Гесса. Общее уравнение образования CaC2:
Ca(тв) + 2C(тв) -> CaC2(тв)
Используя закон Гесса, можно написать:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 кДж + 65,19 кДж + 462,30 кДж – 221,00 кДж – 571,80 кДж = -680,10 кДж
Следовательно, стандартная теплота образования cac2(s) составляет -680,10 кДж/моль.
Вопрос: Сколько граммов cac2 потребуется для образования 0,35 моля hcch(g)?
Ответ: Чтобы ответить на этот вопрос, нам нужно использовать сбалансированное уравнение реакции между CaC2 и водой:
CaC2(т) + 2H2O(ж) -> C2H2(г) + Ca(OH)2(водн.)
Из этого уравнения мы видим, что один моль cac2 производит один моль hcch (также называемый ацетиленом). Следовательно, для образования 0,35 моля ГХЦ нам необходимо 0,35 моля САЦ2. Чтобы преобразовать моли в граммы, нам нужно использовать молярную массу cac2, которая составляет 64,099 г/моль. Умножив моли на молярную массу, получим:
0,35 моль х 64,099 г/моль = 22,435 г
Следовательно, нам нужно 22,435 грамма cac2 для образования 0,35 моля hcch.
Вопрос: Сколько молей cac2 необходимо для полной реакции с 49,0 г воды?
Ответ: Чтобы ответить на этот вопрос, нам нужно использовать сбалансированное уравнение реакции между карбидом кальция и водой:
CaC2(т) + 2H2O(ж) -> C2H2(г) + Ca(OH)2(водн.)
Из этого уравнения мы видим, что один моль cac2 реагирует с двумя молями воды. Следовательно, чтобы найти необходимые моли cac2, нам нужно разделить моли h2o на два. Чтобы перевести граммы в моли, нам нужно использовать молярную массу воды, которая составляет 18,015 г/моль. Разделив граммы на молярную массу, получим:
49,0 г / 18,015 г/моль = 2,72 моля
Разделив это на два, получим:
2,72 моля / 2 = 1,36 моля
Следовательно, нам нужно 1,36 моль cac2, чтобы полностью прореагировать с 49,0 г воды.
Вопрос: Каковы продукты реакции карбида кальция с водой?
Ответ: Продуктами реакции CaC2 с водой являются газообразный ацетилен и раствор гидроксида кальция.
