Что такое аммоний NH4+?
Ион аммония (NH4+) представляет собой положительно заряженный многоатомный ион, состоящий из одного атома азота и четырех атомов водорода. Он обычно содержится в удобрениях и органических соединениях.
| Название ИЮПАК | Азаниум |
| Молекулярная формула | NH4+ |
| Количество CAS | 14798-03-9 |
| Синонимы | Катион аммония, тетрагидридазот (1+), аминоний, азаний, катион гидрида азота, гидроазот, ион азота |
| ИнЧИ | ИнЧИ=1S/H3N/h1H3/p+1 |
Примечание. InChI касается иона аммония в его простейшей форме с одним ионизированным водородом. Реальный InChI может меняться в зависимости от химического окружения иона аммония.
Формула аммония
Формула иона аммония: NH4+. Это многоатомный катион, состоящий из одного атома азота и четырех атомов водорода. Ион аммония образуется в результате протонирования аммиака (NH3) ионом водорода (H+). Ион аммония является распространенным катионом в неорганических и органических соединениях, включая удобрения, фармацевтические препараты и взрывчатые вещества.
Катион аммония
Катион аммония, также известный как NH4+, представляет собой положительно заряженный многоатомный ион, состоящий из одного атома азота и четырех атомов водорода. Он образуется, когда аммиак (NH3) принимает протон (H+) от кислоты, что приводит к образованию соли аммония.
Молярная масса of аммоний ионов
Молярная масса иона аммония (NH4+) составляет 18,04 г/моль. Эта величина рассчитывается путем сложения атомных масс одного атома азота (14,01 г/моль) и четырех атомов водорода (по 1,01 г/моль каждый). Молярная масса является важным свойством иона аммония, поскольку она позволяет конвертировать его массу в моли и наоборот. Это полезно во многих химических расчетах, например, при определении количества реагентов, необходимых для химической реакции.
Температура кипения ионов аммония
Поскольку ион аммония обычно содержится в соли, такой как хлорид аммония (NH4Cl), он не имеет собственной точки кипения. Вместо этого на температуру кипения хлорида аммония, которая составляет 520 ° C, влияют различные факторы, такие как прочность ионной связи между ионом аммония и ионом хлорида, а также размер и форма иона аммония.
Температура плавления ионов аммония
Подобно температуре кипения, ион аммония не имеет температуры плавления, поскольку он не является веществом, существующим в чистом виде. Однако соли, содержащие ион аммония, такие как нитрат аммония (NH4NO3), имеют температуру плавления 169,6°C. На температуру плавления нитрата аммония влияет прочность ионной связи между ионом аммония и нитрат-ионом, а также кристаллическая структура соединения.
Плотность ионов аммония г/мл
Плотность иона аммония (NH4+) не применима, поскольку он является многоатомным ионом и не существует как отдельная сущность. Однако соли, содержащие ион аммония, такие как сульфат аммония (NH4)2SO4, имеют плотность 1,77 г/см³ при комнатной температуре. На плотность солей, содержащих ион аммония, влияют различные факторы, в том числе размер и форма ионов, сила ионной связи и кристаллическая структура соединения.
Молекулярный вес ионов аммония
Молекулярная масса иона аммония (NH4+) составляет 18,04 г/моль, рассчитанная путем сложения атомных масс одного атома азота и четырех атомов водорода. Молекулярный вес является важным свойством иона аммония, поскольку он позволяет переводить его массу в моли и наоборот. Это полезно во многих химических расчетах, например, при определении количества реагентов, необходимых для химической реакции.
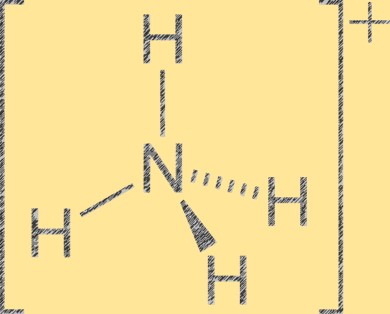
Структура ионов аммония
Ион аммония (NH4+) имеет тетраэдрическую геометрию молекулы с одним атомом азота в центре и четырьмя атомами водорода в углах тетраэдра. Атом азота имеет положительный формальный заряд +1, а каждый атом водорода имеет формальный заряд -1. Ион аммония представляет собой многоатомный катион, образующийся в результате протонирования аммиака (NH3) ионом водорода (H+). Ион аммония является распространенным катионом в неорганических и органических соединениях, включая удобрения, фармацевтические препараты и взрывчатые вещества.
| Появление | Белый или бесцветный кристаллический твердый газ. |
| Удельный вес | Не применимо (многоатомный ион) |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 18,04 г/моль |
| Плотность | Неприменимо (многоатомный ион), плотность соли варьируется (например, 1,77 г/см³ для сульфата аммония) |
| Точка плавления | Неприменимо (многоатомный ион), температура плавления солей варьируется (например, 169,6°C для нитрата аммония) |
| Точка кипения | Неприменимо (многоатомный ион), температура кипения солей варьируется (например, 520 °C для хлорида аммония) |
| Мигающая точка | Не применимо (многоатомный ион) |
| Растворимость в воде | Очень растворим (полностью смешивается) в воде. |
| Растворимость | Растворим в спиртах и жидком аммиаке. |
| Давление газа | Не применимо (многоатомный ион) |
| Плотность пара | Не применимо (многоатомный ион) |
| пКа | 9,25 (сопряженная кислота, катион аммония) |
| рН | 7 (нейтральный) в водном растворе |
Примечание: Значения, представленные в таблице, могут меняться в зависимости от химической формы и конкретных условий содержания иона аммония.
Безопасность и опасность ионов аммония
Ион аммония в чистом виде обычно считается безопасным и нетоксичным. Однако, как и многие химические соединения, ион аммония может представлять определенную опасность и риск, особенно при неправильном обращении или использовании. Ион аммония может выделять токсичный газообразный аммиак при реакции с сильными основаниями или сильными кислотами. Он также может представлять опасность пожара и взрыва при воздействии тепла или пламени. Кроме того, воздействие высоких концентраций ионов аммония или его производных может вызвать раздражение глаз, кожи и дыхательных путей. Важно соблюдать надлежащие протоколы безопасности и обращаться с ионами аммония и его производными осторожно, чтобы избежать потенциальных опасностей.
| Символы опасности | Ни один не назначен для чистого иона аммония |
| Описание безопасности | Вреден при проглатывании, вдыхании или попадании через кожу. Вызывает раздражение кожи, глаз и дыхательных путей. Может выделять токсичный газообразный аммиак. Может представлять опасность пожара и взрыва. |
| ИН ID | 3077 (для соединений аммония, включая соли аммония) |
| код ТН ВЭД | 2827.10.00 (для хлорида аммония, карбоната аммония и других солей аммония) |
| Класс опасности | 9 (Прочие опасные вещества и предметы) для соединений аммония, класс 8 (Коррозионные вещества) для раствора гидроксида аммония |
| Группа упаковки | III (для соединений аммония) |
| Токсичность | Обычно считается нетоксичным в чистом виде, но может выделять токсичный газообразный аммиак. Соединения и производные аммония могут быть токсичными или вредными для здоровья человека и окружающей среды в зависимости от их конкретных свойств и применения. |
Методы синтеза ионов аммония
Ион аммония можно синтезировать различными методами, включая химические реакции и биологические процессы.
Обычным методом синтеза иона аммония является реакция газообразного аммиака с кислотой, такой как соляная или серная кислота, с получением соли аммония. Реакция включает замещение ионов водорода (Н+) в кислоте молекулами аммиака, в результате чего образуются катион аммония (NH4+) и соответствующий анион кислоты (например, хлорид, сульфат). Полученную соль аммония можно очистить и кристаллизовать с получением иона аммония.
Биологические процессы, такие как разложение органических веществ микробами, также могут приводить к образованию ионов аммония. Во время этого процесса азотсодержащие соединения расщепляются бактериями и другими микроорганизмами с образованием аммиака и, в конечном итоге, ионов аммония. Этот процесс известен как аммонификация и является важным этапом азотного цикла.
Другой метод синтеза иона аммония — использование процесса Габера-Боша, который включает реакцию газообразного азота и газообразного водорода в присутствии катализатора при высоком давлении и температуре. Образующийся газообразный аммиак затем может реагировать с кислотой с образованием иона аммония.
Использование ионов аммония
Ион аммония находит различное применение в промышленности, сельском хозяйстве и лабораторных условиях.
Он используется в широком спектре промышленных, сельскохозяйственных и лабораторных условий, поскольку действует в первую очередь как удобрение в сельском хозяйстве, обеспечивая растения легкодоступным азотом и одновременно снижая pH почвы.
Химическая промышленность использует ион аммония в качестве ключевого ингредиента при производстве различных соединений, таких как удобрения, взрывчатые вещества и фармацевтические препараты, а также при синтезе антибиотиков и других фармацевтических препаратов. Ион аммония также действует как взрывчатое вещество в форме нитрата аммония.
В лабораториях исследователи используют ион аммония в качестве реагента во многих химических реакциях, таких как реакции осаждения и органический синтез, а также в качестве буферного агента для стабилизации pH раствора.
Кроме того, ион аммония используется в бытовых чистящих средствах в качестве противомикробного средства из-за его способности убивать бактерии и грибки.
Многократное использование ионов аммония и его универсальность делают его незаменимым соединением в различных отраслях промышленности и применениях.
