Йодид кальция (CaI2) — химическое соединение, состоящее из кальция и йода. Он обычно используется в качестве добавки йода и в фотографии в качестве усилителя фотографии.
| Название ИЮПАК | Йодид кальция |
| Молекулярная формула | CaI2 |
| Количество CAS | 10102-68-8 |
| Синонимы | Дийодид кальция, йодид кальция, йодид кальция |
| ИнЧИ | InChI=1S/Ca.2HI/h;2*1H/q+2;;/p-2 |
Свойства йодида кальция
Формула йодида кальция
Химическая формула йодида кальция: CaI2. Это указывает на то, что на каждый атом кальция в соединении приходится два атома йода. Йодид кальция представляет собой белое кристаллическое твердое вещество, хорошо растворимое в воде и других полярных растворителях. Он обычно используется в качестве источника йода в кормах для животных и в качестве компонента усилителей фотографии.
йодид кальция Молярная масса
CaI2 имеет молярную массу примерно 293,89 г/моль. Это рассчитывается путем сложения атомных масс Ca (40,08 г/моль) и I (126,9 г/моль), умноженного на два, поскольку в CaI2 два атома I. Молярная масса соединения является важным свойством, используемым в стехиометрических расчетах, которые включают определение количества необходимых реагентов или количества продуктов, образующихся в химической реакции.
Температура кипения йодида кальция
Температура кипения CaI2 составляет примерно 1,327 °C (2,421 °F). Такая высокая температура кипения обусловлена прочной ионной связью между атомами кальция и йода соединения. CaI2 обычно используется при высоких температурах, например, при производстве сплавов и керамики.
Йодид кальция Температура плавления
CaI2 имеет температуру плавления примерно 779°C (1434°F). Высокая температура плавления CaI2 обусловлена прочной ионной связью между атомами Ca и I соединения. CaI2 часто используется в высокотемпературных приложениях, например, при производстве расплавленных солей и в качестве теплоносителя.
Плотность йодида кальция г/мл
Плотность CaI2 составляет примерно 4,51 г/мл. Такая высокая плотность обусловлена наличием двух атомов I на каждый атом Ca в соединении. CaI2 обычно используется в качестве источника йода в кормах для животных и в качестве компонента усилителей фотографии.
Йодид кальция Молекулярный вес
Молекулярная масса CaI2 составляет примерно 293,89 г/моль. Это рассчитывается путем сложения атомных масс Ca и I, умноженных на два, поскольку в соединении два атома I. Молекулярная масса соединения является важным свойством, используемым в стехиометрических расчетах, которые включают определение количества необходимых реагентов или количества продуктов, образующихся в химической реакции.
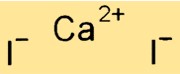
Структура йодида кальция
CaI2 имеет кристаллическую структуру, подобную хлориду натрия (NaCl). Он образует гранецентрированную кубическую решетку, в которой ионы Ca+2 занимают углы куба, а ионы I- — центры граней. Прочные ионные связи между атомами Ca и I в соединении придают ему высокую температуру плавления и кипения.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 4.51 |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 293,89 г/моль |
| Плотность | 4,51 г/мл |
| Точка плавления | 779°С (1434°Ф) |
| Точка кипения | 1327°С (2421°F) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в этаноле и ацетоне |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность йодида кальция
CaI2 обычно считается безопасным и нетоксичным при правильном обращении и использовании. Однако он может вызвать раздражение кожи, глаз и дыхательных путей при попадании на них. Вдыхание пыли CaI2 может вызвать раздражение легких и горла. При работе с CaI2 важно носить соответствующие средства индивидуальной защиты, такие как перчатки, очки и респиратор. CaI2 не считается легковоспламеняющимся или взрывоопасным, и не известно, что он канцерогенен или мутагенен. Важно соблюдать надлежащие процедуры обращения и хранения, чтобы свести к минимуму любые потенциальные опасности.
| Символы опасности | Хн,Н |
| Описание безопасности | 26-36/37/39-45-61 |
| Идентификационные номера ООН | ООН3077 |
| код ТН ВЭД | 28276000 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | Может раздражать, быть вредным при проглатывании или вдыхании и может вызвать повреждение органов при длительном или многократном воздействии. |
Методы синтеза йодида кальция
Наиболее распространенным методом синтеза CaI2 является реакция иодоводородной кислоты или йода с карбонатом или гидроксидом кальция.
Реакция карбоната или гидроксида кальция с иодистоводородной кислотой или йодом для синтеза CaI2.
Второй метод включает реакцию оксида кальция с йодом с образованием CaI2 и газообразного кислорода. Гидроксид кальция также может выполнять эту реакцию вместо оксида кальция .
Другой метод получения CaI2 включает реакцию металлического кальция с йодом. Кальций реагирует с йодом с образованием CaI2 и выделением тепла. Гидрид кальция заменяет металлический кальций в реакции образования CaI2.
Реакция кальция с иодоводородной кислотой в присутствии восстановителя, такого как железо или цинк, приводит к образованию CaI2. Упарьте раствор, чтобы получить кристаллы CaI2.
Использование йодида кальция
CaI2 имеет несколько применений в различных отраслях, в том числе:
- Медицинские: используется в качестве источника йода для пищевых добавок и фармацевтических препаратов, таких как гормоны щитовидной железы и радиофармацевтические препараты.
- Химический синтез: используется в качестве катализатора в нескольких химических реакциях, включая превращение спиртов в алкилйодиды и дегидратацию первичных амидов в нитрилы.
- Фотография: Используется при производстве фотопленок и бумаги в качестве сенсибилизатора к бромиду и хлориду серебра.
- Электроника: используется при производстве полупроводников, сцинтилляционных детекторов и радиационной защиты.
- Пищевая промышленность: используется в качестве добавки в пищевой промышленности в качестве источника йода для обогащения пищевых продуктов.
- Корма для животных: используется в качестве добавки к кормам для животных для предотвращения дефицита йода и улучшения здоровья животных.
- Нефтяная и газовая промышленность: также используется в качестве добавки к буровому раствору в нефтегазовой промышленности для стабилизации сланцевых пластов и предотвращения обрушения ствола скважины.
Вопросы:
Вопрос: Какой объем 0,120 М раствора CaI2 будет содержать 0,078 моль растворенного вещества?
Ответ: Чтобы рассчитать объем раствора CaI2, содержащего 0,078 моль растворенного вещества, мы можем использовать формулу: моли = концентрация х объем. Преобразовав эту формулу для вычисления объема, мы получим объем = моль/концентрация. Подставив значения, приведенные в вопросе, получим объем = 0,078 моль/0,120 М = 0,65 л. Следовательно, объем раствора CaI2, содержащего 0,078 моль растворенного вещества, равен 0,65 л.
Вопрос: Растворим ли CaI2 в воде?
Ответ: Да, CaI2 хорошо растворим в воде, его растворимость составляет 121 г/100 мл при 20°C.
Вопрос: Как называется соединение с формулой CaI2?
Ответ: Соединение формулы CaI2 называется йодидом кальция.
Вопрос: Что такое CaI2?
Ответ: CaI2 — это химическое соединение, состоящее из кальция и йода. Это белое или бесцветное кристаллическое вещество, хорошо растворимое в воде.
Вопрос: Какая реакция происходит на аноде при электролизе CaI2?
Ответ: При электролизе CaI2 анодная реакция включает окисление ионов I- с образованием газообразного йода и электронов. Общая реакция: 2I- -> I2 + 2e-.
Вопрос: Какова формула йодида кальция?
Ответ: Формула йодида кальция: CaI2.
Вопрос: CaI2 ионный или ковалентный?
Ответ: CaI2 представляет собой ионное соединение, состоящее из катиона металла (Ca2+) и аниона неметалла (I-).
