Дигидрат хлорида бария представляет собой белое кристаллическое соединение с химической формулой BaCl2·2H2O. Его обычно используют в лаборатории в качестве реагента и в промышленности для обработки металлических поверхностей.
| Название ИЮПАК | Дигидрат хлорида бария |
| Молекулярная формула | BaCl2·2H2O |
| Количество CAS | 10326-27-9 |
| Синонимы | Дигидрат дихлорида бария; бария(II) хлорид дигидрат; Гидратированный хлорид бария (1:2:2); Хлорид бария 2-гидрат; Бария хлорид дигидрат; Бария дихлорид, дигидрат; Дигидрат хлорида бария(2+) |
| ИнЧИ | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
BaCl2·2H2O молярная масса
Молярная масса дигидрата хлорида бария (BaCl2·2H2O) составляет 244,26 г/моль. Это значение можно рассчитать, сложив атомные массы каждого элемента, присутствующего в соединении. Барий имеет молярную массу 137,33 г/моль, хлор имеет молярную массу 35,45 г/моль, а водород и кислород имеют молярные массы 1,01 г/моль и 16,00 г/моль соответственно. Две молекулы воды добавляют еще 36,02 г/моль. Молярная масса BaCl2·2H2O важна в стехиометрических расчетах, где количество реагента или продукта выражается в молях.
Формула дигидрата хлорида бария
Химическая формула дигидрата хлорида бария: BaCl2·2H2O. Эта формула указывает на то, что каждая формульная единица соединения содержит один ион бария, два иона хлорида и две молекулы воды. Формула важна для стехиометрических расчетов и для понимания химических и физических свойств соединения.
Температура кипения дигидрата хлорида бария
BaCl2·2H2O имеет температуру кипения 1560°C. При этой температуре соединение претерпит фазовый переход из жидкости в газ. Высокая температура кипения обусловлена ионной природой соединения, которая требует большого количества энергии для разрушения сильных электростатических сил, удерживающих ионы вместе. BaCl2 · 2H2O применяется в промышленности в качестве средства для термической обработки металлических поверхностей из-за высоких температур плавления и кипения.
Температура плавления дигидрата хлорида бария
Температура плавления BaCl2 · 2H2O составляет 962 °С. При этой температуре соединение переходит из твердого состояния в жидкость. Высокая температура плавления BaCl2·2H2O обусловлена прочными ионными связями между ионами бария и хлора, а также водородными связями между молекулами воды. Температура плавления BaCl2·2H2O является важным свойством для его использования в различных областях, таких как производство пигментов и красителей, а также обработка металлических поверхностей.
Плотность дигидрата хлорида бария г/мл
Плотность дигидрата хлорида бария составляет 3,097 г/см³. Это означает, что 1 см³ дигидрата хлорида бария весит 3,097 грамма. Плотность вещества — важное свойство, которое может дать представление о его физических и химических свойствах. В случае дигидрата хлорида бария высокая плотность обусловлена относительно большой атомной массой бария и плотной упаковкой ионов в структуре кристаллической решетки.
Молекулярная масса BaCl2 · 2H2O
Молекулярная масса BaCl2·2H2O составляет 244,26 г/моль. Это значение можно рассчитать путем сложения атомных масс каждого элемента, присутствующего в соединении. Молекулярная масса является важным свойством BaCl2 · 2H2O, поскольку он используется в различных приложениях, таких как производство пигментов и красителей, а также в качестве реагента в лабораторных экспериментах.
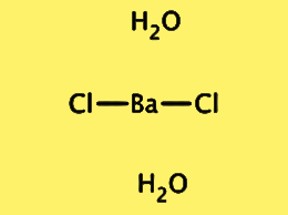
Структура BaCl2·2H2O
Кристаллическая структура BaCl2·2H2O ромбическая, с пространственной группой Pnma. Элементарная ячейка содержит одну единицу с формулой BaCl2·2H2O, состоящую из одного иона бария, двух ионов хлорида и двух молекул воды. Ион бария окружен восемью ионами хлорида, а молекулы воды связаны водородными связями с ионами хлорида. Кристаллическая структура BaCl2 · 2H2O важна для понимания его физических и химических свойств, а также его использования в различных приложениях.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 3,097 г/см³ |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 244,26 г/моль |
| Плотность | 3,097 г/см³ |
| Точка плавления | 962°С |
| Точка кипения | 1560°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 31,2 г/100 мл (при 20°С) |
| Растворимость | Растворим в спирте и ацетоне |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нейтральный (7) |
Примечание. Таблица может быть выровнена неправильно в зависимости от настроек дисплея используемой вами платформы или устройства.
Безопасность и опасность дигидрата хлорида бария
BaCl2 · 2H2O представляет собой ряд опасностей для безопасности и здоровья, которые могут быть вредными при неправильном обращении. Это едкое вещество, которое при попадании может вызвать серьезные ожоги кожи и глаз. Вдыхание его пыли или паров может вызвать проблемы с дыханием и повреждение легких. Он также токсичен при проглатывании и может вызвать проблемы с желудочно-кишечным трактом. С BaCl2 · 2H2O следует обращаться с осторожностью и при работе с составом следует надевать соответствующие защитные средства, такие как перчатки, очки и респираторы. Его следует хранить вдали от несовместимых веществ и в безопасном месте, чтобы предотвратить случайное воздействие. В случае возникновения чрезвычайной ситуации немедленно обратитесь за медицинской помощью.
| Символы опасности | Коррозионный (С) | |
| Описание безопасности | ||
| Идентификаторы сети | ООН 1564 | |
| код ТН ВЭД | 28273990 | |
| Класс опасности | 8 | |
| Группа упаковки | III | |
| Токсичность | Токсично при проглатывании; может вызвать проблемы с желудочно-кишечным трактом. Разъедает кожу и глаза. Вдыхание пыли или паров может вызвать проблемы с дыханием и повреждение легких. | |
Методы синтеза дигидрата хлорида бария
Синтезировать BaCl2·2H2O можно несколькими методами.
Распространенным методом является взаимодействие карбоната или гидроксида бария с соляной кислотой. Необходимо выпарить полученный раствор, чтобы получить твердое соединение.
Другой метод — взаимодействие сульфида бария с соляной кислотой. В результате этой реакции образуется сероводород, от которого необходимо правильно избавиться. Полученный раствор затем очищают фильтрованием и кристаллизацией с получением конечного продукта.
Синтезировать BaCl2·2H2O можно также реакцией осаждения с использованием хлорида натрия и нитрата бария. Вам необходимо смешать два соединения в растворе, затем отфильтровать и высушить образовавшийся осадок, чтобы получить твердое соединение.
Кроме того, BaCl2 · 2H2O можно синтезировать реакцией оксида бария с соляной кислотой. В результате этой реакции в качестве побочного продукта образуется вода, которую необходимо удалить путем испарения. Полученный раствор затем кристаллизуют с получением конечного продукта.
При работе с BaCl2·2H2O необходимо соблюдать соответствующие меры безопасности, так как это едкое и токсичное соединение. Вам следует носить защитное оборудование, такое как перчатки, очки и респираторы, и работать с составом в хорошо проветриваемом помещении.
Использование дигидрата хлорида бария
BaCl2 · 2H2O имеет несколько применений в различных отраслях промышленности.
- Химическая промышленность использует BaCl2 · 2H2O в качестве реагента в ряде химических реакций, например, при производстве солей бария, пигментов и керамики.
- Он действует как флюс при рафинировании металлов и как катализатор в органическом синтезе.
- Медицинская промышленность использует BaCl2 · 2H2O в качестве контрастного вещества при рентгенографии и для лечения отравления барием. Он также используется в производстве стоматологических цементов.
- Текстильная промышленность использует BaCl2·2H2O в качестве протравы, вещества, связывающего красители с волокнами, а также в качестве антипирена для текстиля.
- В нефтяной промышленности BaCl2 · 2H2O используется в качестве добавки к буровому раствору для увеличения плотности раствора и предотвращения выбросов при бурении.
- В пищевой промышленности BaCl2·2H2O используется в качестве консерванта и усилителя вкуса некоторых продуктов питания.
Для минимизации рисков, связанных с работой с коррозионным и токсичным BaCl2 · 2H2O, следует принять соответствующие меры безопасности, такие как ношение защитного снаряжения и работа с составом в хорошо проветриваемом помещении.
Вопросы:
Какова формула дигидрата хлорида бария?
Формула дигидрата хлорида бария: BaCl2·2H2O.
Растворяется ли дигидрат хлорида бария в воде?
Да, дигидрат хлорида бария хорошо растворим в воде. Он легко растворяется в воде, его растворимость составляет примерно 31,2 г/100 мл при комнатной температуре. Высокая растворимость делает его полезным соединением в различных отраслях промышленности, например, при производстве солей бария и в качестве добавки к буровому раствору в нефтяной промышленности. Однако его высокая растворимость также означает, что при неправильном обращении он может представлять опасность для здоровья человека и окружающей среды, поскольку может загрязнять источники воды и вызывать токсичность для водных организмов. Поэтому при работе с BaCl2 · 2H2O следует принимать соответствующие меры предосторожности, чтобы избежать загрязнения и обеспечить безопасное обращение.
