Гидроксид никеля (Ni(OH)2) представляет собой химическое соединение, состоящее из ионов никеля и гидроксида. Он обычно используется в качестве предшественника батарей на основе никеля.
| Название ИЮПАК | Гидроксид никеля |
| Молекулярная формула | Ni(OH)2 |
| Количество CAS | 12054-48-7 |
| Синонимы | гидроксид никеля(II); гидроксид никеля; Азот, триоксид никеля (2+) |
| ИнЧИ | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Свойства гидроксида никеля
Формула гидроксида никеля
Формула гидроксида никеля: Ni(OH)2. Он состоит из одного иона никеля (Ni) и двух ионов гидроксида (OH-). Эта химическая формула представляет состав гидроксида никеля на атомном уровне.
гидроксид никеля Молярная масса
Молярная масса Ni(OH)2 рассчитывается путем сложения атомных масс составляющих его элементов. Атомная масса никеля составляет 58,6934 г/моль, а масса каждого гидроксид-иона составляет 17,007 г/моль. Сложив их, молярная масса Ni(OH)2 составит примерно 92,6934 г/моль.
Температура кипения гидроксида никеля
Ni(OH)2 не имеет четко определенной температуры кипения, поскольку при нагревании он разлагается. При высоких температурах он подвергается термическому разложению и превращается в оксид никеля (NiO) и водяной пар.
Температура плавления гидроксида никеля
Температура плавления Ni(OH)2 составляет примерно 230°С. При этой температуре Ni(OH)2 претерпевает фазовый переход из твердого состояния в жидкое. Соединение плавится, позволяя проводить дальнейшие химические реакции или обработки.
Плотность гидроксида никеля г/мл
Плотность Ni(OH)2 составляет примерно 4,1 г/мл. Это значение представляет собой массу соединения на единицу объема. Он указывает на компактность или концентрацию Ni(OH)2 в данном пространстве.
Гидроксид никеля Молекулярный вес
Молекулярная масса Ni(OH)2 определяется сложением атомных масс составляющих его элементов. Никель имеет атомный вес 58,6934 г/моль, а каждый гидроксид-ион весит 17,007 г/моль. Таким образом, молекулярная масса Ni(OH)2 составляет примерно 92,6934 г/моль.
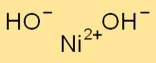
Структура гидроксида никеля
Ni(OH)2 кристаллизуется в гексагональной кристаллической системе. Он образует слои ионов Ni+2 и OH-, наложенных друг на друга. Ионы Ni+2 скоординированно окружены ионами OH-, создавая сетчатую структуру.
Растворимость гидроксида никеля
Ni(OH)2 плохо растворяется в воде. Он в некоторой степени растворяется, образуя слабощелочной раствор из-за присутствия гидроксид-ионов. На растворимость Ni(OH)2 могут влиять такие факторы, как температура и pH.
| Появление | Сплошной зеленый |
| Удельный вес | 4,1 г/мл |
| Цвет | Зеленый |
| Запах | Без запаха |
| Молярная масса | 92,6934 г/моль |
| Плотность | 4,1 г/мл |
| Точка плавления | 230°С |
| Точка кипения | Разложившийся |
| Мигающая точка | Н/Д |
| Растворимость в воде | Слегка растворим |
| Растворимость | Нерастворим, образует щелочной раствор в воде. |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Щелочной |
Безопасность и опасность гидроксида никеля
Ni(OH)2 представляет определенные риски для безопасности, которые необходимо учитывать. Он может вызвать раздражение кожи, глаз и дыхательной системы при контакте или вдыхании. Длительное или неоднократное воздействие может привести к сенсибилизации, вызывая аллергические реакции. Важно обращаться с Ni(OH)2 осторожно, используя соответствующие защитные меры, такие как перчатки, очки и респиратор. В случае проглатывания или случайного воздействия следует немедленно обратиться за медицинской помощью. Кроме того, Ni(OH)2 считается опасным для окружающей среды и должен утилизироваться должным образом в соответствии с правилами, чтобы предотвратить загрязнение почвы или источников воды.
| Символы опасности | Никто |
| Описание безопасности | – Может вызвать раздражение кожи и глаз\n- Может вызвать раздражение дыхательных путей\n- Возможна сенсибилизация\n- Соблюдайте надлежащие процедуры обращения и утилизации. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2825.70.10 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Считается низкой и умеренной токсичностью. |
Обратите внимание, что символы опасности и идентификаторы ООН не относятся к Ni(OH)2, поскольку он не классифицируется как опасное вещество. В описании безопасности подчеркиваются потенциальные риски и меры предосторожности, связанные с обращением с Ni(OH)2. Токсичность Ni(OH)2 обычно считается низкой или умеренной.
Методы синтеза гидроксида никеля
Существует несколько методов синтеза Ni(OH)2. Обычный метод включает реакцию между растворимой солью никеля, такой как сульфат никеля или нитрат никеля, и щелочным гидроксидом, обычно гидроксидом натрия или гидроксидом калия. Реакция протекает в водном растворе в контролируемых условиях, в результате чего образуется осадок Ni(OH)2.
В методе электрохимического осаждения в качестве электрода в электролитической ячейке используется металлический никель. Он применяет соответствующий электрический ток для удаления ионов никеля из электролита и осаждения их на электроде в форме Ni(OH)2. Этот метод позволяет точно контролировать состав и морфологию получаемого Ni(OH)2.
Термическое разложение солей никеля позволяет получить Ni(OH)2. При нагревании соли никеля, такой как карбонат никеля или сам Ni(OH)2, в контролируемой среде соединение подвергается разложению с образованием Ni(OH)2, а также других побочных продуктов.
Стоит отметить, что выбор метода синтеза зависит от таких факторов, как желаемая чистота, размер частиц и конкретные требования применения. При выборе подходящего пути синтеза Ni(OH)2 необходимо тщательно учитывать желаемый результат из-за преимуществ и ограничений, связанных с каждым методом.
Использование гидроксида никеля
Ni(OH)2 находит разнообразное применение благодаря своим уникальным свойствам. Вот некоторые распространенные варианты использования Ni(OH)2:
- Производство аккумуляторов: Ni(OH)2 играет решающую роль в качестве катодного материала в батареях на основе никеля, таких как никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи. Он хранит и высвобождает электрическую энергию, обеспечивая эффективное хранение энергии.
- Катализатор: Ni(OH)2 действует как катализатор в различных химических реакциях, включая процессы гидрирования и окисления. Его каталитические свойства способствуют эффективному превращению реагентов в желаемые продукты.
- Гальваника: Ni(OH)2 образует стабильный, липкий слой никеля, что делает его ценным при гальванике. Обеспечивает защитное, антикоррозийное и эстетически привлекательное покрытие на различных металлических поверхностях.
- Пигменты: производители используют Ni(OH)2 в качестве зеленого пигмента при производстве керамики, стекла и пластмасс. Его яркий зеленый цвет повышает эстетическую ценность этих материалов.
- Датчики газа: датчики на основе Ni(OH)2 обнаруживают и контролируют такие газы, как водород, аммиак и сероводород. Изменение электропроводности пленок Ni(OH)2 позволяет эффективно обнаруживать эти газы.
- Очистка воды: Ni(OH)2 способствует процессам очистки воды, избирательно адсорбируя и удаляя примеси тяжелых металлов, таких как свинец и кадмий. Он проявляет сродство к этим металлам, что делает его полезным для их удаления из водных источников.
- Фармацевтическое применение: Ni(OH)2 находит применение в фармацевтических составах, выступая в качестве связующего вещества, дезинтегратора или регулятора pH в составах таблеток или капсул.
Это лишь несколько примеров различных применений Ni(OH)2, демонстрирующих его универсальность и важность в различных отраслях промышленности.
Вопросы:
Вопрос: Какова химическая формула основного гидроксида никеля(II)?
Ответ: Химическая формула гидроксида никеля(II) — Ni(OH)2.
Вопрос: Растворяется ли гидроксид никеля в воде?
Ответ: Ni(OH)2 нерастворим в воде.
Вопрос: Сколько граммов хлорида никеля(II) необходимо для нейтрализации 75,0 мл 0,555 М гидроксида лития?
Ответ: Необходимое количество хлорида никеля можно рассчитать, используя стехиометрию и молярность раствора гидроксида лития.
Вопрос: Какой заряд представляет собой Ni(OH)2?
Ответ: Заряд Ni(OH)2 нейтральный или нулевой.
Вопрос: Как рассчитать молярную растворимость Ni(OH)2?
A: Молярную растворимость Ni(OH)2 можно определить путем деления количества молей растворенного соединения на объем раствора.
Вопрос: Какова сбалансированная форма уравнения NaOH(водный раствор) + NiCl2(водный раствор) → NaCl(водный раствор) + Ni(OH)2(тв)?
Ответ: Сбалансированное уравнение: 2NaOH(водный раствор) + NiCl2(водный раствор) → 2NaCl(водный раствор) + Ni(OH)2(тв).
Вопрос: Сколько граммов на моль содержит Ni(OH)2?
A: Молярная масса Ni(OH)2 составляет примерно 92,6934 г/моль.
Вопрос: Растворим ли Ni(OH)2 в воде?
О: Нет, Ni(OH)2 нерастворим в воде.
Вопрос: Какой восстановитель в реакции: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
Ответ: Восстановителем в реакции является магний (Mg).
Вопрос: Является ли Ni(OH)2 твердым веществом?
Ответ: Да, Ni(OH)2 — твердое соединение.
Вопрос: Если потенциал элемента составляет 0,247 В при 25°C, каков Ksp Ni(OH)2?
Ответ: Ksp Ni(OH)2 можно определить с помощью уравнения Нернста и потенциала ячейки.
Вопрос: Какие соли более растворимы в кислом растворе, чем в чистой воде?
Ответ: Соли, подобные Ni(OH)2, будут более растворимы в кислом растворе из-за реакции нейтрализации кислотой.
