Гидроксид меди (Cu(OH)2) представляет собой твердое вещество синего цвета, образующееся в результате реакции солей меди с ионами гидроксида. Его используют в качестве фунгицида и в различных химических процессах.
| Название ИЮПАК | Гидроксид меди(II) |
| Молекулярная формула | Cu(OH)2 |
| Количество CAS | 20427-59-2 |
| Синонимы | Гидроксид меди; Медь дигидроксид; CuOH2 |
| ИнЧИ | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Свойства гидроксида меди
Формула гидроксида меди
Химическая формула гидроксида меди: Cu(OH)2. Он представляет собой комбинацию иона меди (Cu2+) и двух ионов OH-, удерживаемых вместе ионными связями. Это твердое соединение синего цвета широко используется в различных отраслях промышленности благодаря своим уникальным свойствам.
гидроксид меди Молярная масса
Молярную массу гидроксида меди (Cu(OH)2) можно рассчитать путем сложения атомных масс составляющих его элементов. Медь (Cu) имеет атомную массу примерно 63,55 г/моль, а общая атомная масса каждого иона OH- составляет примерно 17,01 г/моль. Таким образом, молярная масса гидроксида меди составляет примерно 97,55 г/моль.
Температура кипения гидроксида меди
Гидроксид меди не имеет четко выраженной точки кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании он подвергается реакции термического разложения с образованием оксида меди и водяного пара.
Температура плавления гидроксида меди
Гидроксид меди имеет температуру плавления около 200°C (392°F). При этой температуре твердое тело претерпевает фазовый переход и переходит в жидкое состояние.
Плотность гидроксида меди г/мл
Плотность гидроксида меди составляет примерно 3,36 г/мл. Это значение представляет собой массу одного миллилитра гидроксида меди, что указывает на его компактность и концентрацию.
Гидроксид меди Молекулярный вес
Молекулярная масса гидроксида меди составляет примерно 97,55 г/моль. Он рассчитывается путем сложения атомных весов всех атомов, присутствующих в молекуле гидроксида меди.
Структура гидроксида меди
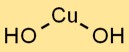
Гидроксид меди имеет кристаллическую структуру, в которой ионы Cu2+ окружены ионами OH- в тригонально-планарном расположении. Такое расположение кристаллической решетки способствует его стабильности и отличительным свойствам.
Растворимость гидроксида меди
Гидроксид меди имеет ограниченную растворимость в воде. Он образует суспензию, плохо растворимую в воде, то есть в растворителе растворяется лишь небольшое количество соединения. На растворимость могут влиять такие факторы, как температура и pH.
| Появление | Сплошной синий |
| Удельный вес | ~3,36 г/мл |
| Цвет | Синий |
| Запах | Без запаха |
| Молярная масса | ~97,55 г/моль |
| Плотность | ~3,36 г/мл |
| Точка плавления | ~200°С (392°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Н/Д |
| Растворимость в воде | Плохо растворим |
| Растворимость | Ограничено, зависит от температуры и уровня pH. |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Щелочная (основная) |
Безопасность и опасность гидроксида меди
Гидроксид меди представляет определенные соображения безопасности и опасности. Обычно считается, что он малотоксичен, но может вызывать раздражение кожи, глаз и дыхательных путей при контакте или вдыхании. При работе с этим соединением следует принимать соответствующие защитные меры, такие как ношение перчаток и защитных очков. В случае проглатывания или случайного воздействия требуется немедленная медицинская помощь. Кроме того, гидроксид меди следует хранить в безопасном, хорошо вентилируемом помещении вдали от несовместимых веществ. Необходимо соблюдать надлежащие процедуры утилизации, чтобы избежать загрязнения окружающей среды. Соблюдение мер безопасности имеет решающее значение для минимизации потенциальных рисков, связанных с гидроксидом меди.
| Символы опасности | Никто |
| Описание безопасности | Низкая токсичность; Раздражающий |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2825.90.5000 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Неклассифицированный |
| Токсичность | Слабый |
Методы синтеза гидроксида меди
Существует несколько активных методов синтеза гидроксида меди.
Обычный подход включает реакцию соли меди, такой как CuSO4 , с сильным основанием, таким как гидроксид натрия (NaOH) или гидроксид калия (KOH) . Во время этого процесса ионы гидроксида (OH-) основания вытесняют ионы сульфата (SO4^2-) в CuSO4 , образуя гидроксид меди (Cu(OH)2) в виде синего осадка.
Другой метод включает реакцию соли меди(II) с аммиаком (NH3). При добавлении аммиака к раствору Cu(II) гидроксид меди выпадает в осадок за счет соединения ионов Cu2+ с гидроксид-ионами аммиака.
Электролиз позволяет синтезировать гидроксид меди путем погружения медного электрода в раствор электролита и подачи постоянного электрического тока. Восстановление воды на катоде приводит к образованию ионов гидроксида, что приводит к образованию гидроксида меди.
Эти методы активного синтеза обеспечивают контролируемые и эффективные способы производства гидроксида меди для различных промышленных и исследовательских целей.
Использование гидроксида меди
Гидроксид меди находит множество применений в различных отраслях промышленности благодаря своим уникальным свойствам и универсальному характеру. Некоторые известные варианты использования включают:
- Фунгицид: Фермеры широко используют его в качестве защитного фунгицида для борьбы с грибковыми заболеваниями таких культур, как фрукты, овощи и декоративные растения.
- Химические промежуточные соединения: он служит ценным химическим промежуточным продуктом при синтезе различных соединений меди, таких как оксид меди и соли меди.
- Консервант для древесины: обрабатывает древесину и обеспечивает защиту от деревоядных насекомых и грибков, вызывающих гниение, тем самым продлевая срок службы деревянных конструкций.
- Антибактериальный агент: в некоторых составах он действует как антибактериальный агент, находя применение в медицине и здравоохранении.
- Обработка воды: помогает бороться с водорослями и водными сорняками в прудах, озерах и других водоемах, поддерживая экологический баланс.
- Керамическая и стекольная промышленность: производители используют его в качестве красителя, чтобы придать керамическим и стеклянным изделиям яркие синие и зеленые оттенки.
- Пиротехника: способствует окраске фейерверков и сигнальных ракет, играет роль в пиротехнических целях.
- Производство аккумуляторов: он находит применение при производстве аккумуляторов в качестве электродного материала, способствующего накоплению энергии.
- Краски и покрытия: некоторые составы красок включают его для придания защитных и противомикробных свойств.
Разнообразие применений подчеркивает важность гидроксида меди во многих отраслях промышленности, что делает его ценным соединением для различных практических применений.
Вопросы:
Вопрос: Растворим ли гидроксид меди?
Ответ: Гидроксид меди ограниченно растворяется в воде, образуя плохо растворимую суспензию.
Вопрос: Сколько молей содержится в 68 граммах гидроксида меди(II) Cu(OH)2?
Ответ: В 68 граммах содержится примерно 0,697 моля Cu(OH)2.
Вопрос: Растворим ли гидроксид меди II в воде?
Ответ: Гидроксид меди II имеет ограниченную растворимость в воде.
Вопрос: Является ли гидроксид натрия и сульфат меди химической реакцией?
Ответ: Да, реакция между NaOH и CuSO4 приводит к образованию гидроксида меди и сульфата натрия.
Вопрос: Растворим ли гидроксид меди(II)?
Ответ: Гидроксид меди(II) ограниченно растворяется в воде.
Вопрос: Какого цвета гидроксид меди?
Ответ: Гидроксид меди имеет синий цвет.
Вопрос: Является ли гидроксид меди щелочью?
Ответ: Гидроксид меди является основанием, но не относится к щелочам.
Вопрос: Является ли гидроксид меди сильным основанием?
Ответ: Гидроксид меди не считается сильным основанием.
Вопрос: Растворим ли Cu(OH)2 в воде?
Ответ: Cu(OH)2 имеет ограниченную растворимость в воде.
Вопрос: Сколько молей содержится в 68 граммах гидроксида меди(II) Cu(OH)2?
Ответ: В 68 граммах содержится примерно 0,697 моля Cu(OH)2.
Вопрос: Сколько молей в 34 граммах Cu(OH)2?
Ответ: В 34 граммах содержится примерно 0,3485 моля Cu(OH)2.
Вопрос: Образуется ли твердое вещество Cu(OH)2 при растворении 0,075 г КОН в 1,0 л Cu(NO3)2 при концентрации 1,0 × 10^-3 М?
Ответ: Да, твердый Cu(OH)2 образуется в виде осадка в результате реакции между KOH и Cu(NO3)2.
