Гидроксид кальция (Ca(OH)2) — химическое соединение, используемое в различных областях, таких как производство продуктов питания, очистка воды и строительство. Он производится путем смешивания оксида кальция с водой и имеет белый порошкообразный вид.
| Название ИЮПАК | Гидроксид кальция |
| Молекулярная формула | Са(ОН)2 |
| Количество CAS | 1305-62-0 |
| Синонимы | Гашеная известь, гашеная известь, известковое молоко, маринованная известь |
| ИнЧИ | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Свойства гидроксида кальция
Формула гидроксида кальция
Химическая формула гидроксида кальция: Ca(OH)2. Это означает, что каждая молекула гидроксида кальция содержит один ион Са2+ и два иона ОН-. Формула важна в химии, поскольку она отражает количество и типы атомов в соединении.
гидроксид кальция Молярная масса
Ca(OH)2 имеет молярную массу 74,09 г/моль. Он состоит из одного атома кальция, двух атомов кислорода и двух атомов водорода. Молярная масса является важным свойством в химии, поскольку она используется для расчета количества вещества в данном образце.
Температура кипения гидроксида кальция
Ca(OH)2 имеет очень высокую температуру кипения — 2400°C. Это означает, что для превращения его из жидкости в газ требуется значительное количество тепла. Высокая температура кипения обусловлена прочными ионными связями между ионами кальция и гидроксида.
Температура плавления гидроксида кальция
Ca(OH)2 имеет относительно низкую температуру плавления — 580°C. Это означает, что его можно легко расплавить и придать ему различные формы. Низкая температура плавления обусловлена ионной природой соединения, которая позволяет ионам более свободно перемещаться при нагревании.
Плотность гидроксида кальция г/мл
Плотность Ca(OH)2 составляет 2,24 г/мл. Это означает, что это относительно тяжелое соединение по сравнению с водой, плотность которой составляет 1 г/мл. Высокая плотность обусловлена очень компактной природой ионов Ca2+ и OH-.
Гидроксид кальция Молекулярный вес
Молекулярная масса Ca(OH)2 составляет 74,09 г/моль. Это сумма атомных весов атомов кальция, кислорода и водорода в соединении. Молекулярная масса является важным свойством в химии, поскольку она используется для расчета различных параметров, таких как молярность и процентное содержание состава.
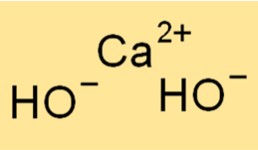
Структура гидроксида кальция
Ca(OH)2 имеет кристаллическую структуру, в которой каждый ион кальция окружен шестью ионами гидроксида в октаэдрическом расположении. Эта структура придает соединению характерный белый порошкообразный вид. Ионные связи между ионами Ca2+ и OH- прочные, что придает этому соединению высокие температуры плавления и кипения.
| Появление | белый порошок |
| Удельный вес | 2,24 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 74,09 г/моль |
| Плотность | 2,24 г/см³ |
| Точка плавления | 580°С |
| Точка кипения | 2400°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | 1,7 г/л (20°С) |
| Растворимость | Растворим в кислотах |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 12,5 (первая диссоциация) |
| рН | 12,5 (0,1 М раствор, 25°С) |
Безопасность и опасность гидроксида кальция
Ca(OH)2 обычно считается безопасным при правильном обращении. Однако он может быть вредным при проглатывании, вдыхании или при попадании на кожу или в глаза. Это может вызвать раздражение, ожоги и проблемы с дыханием. Пыль от соединения также может раздражать дыхательную систему. При работе с Ca(OH)2 следует надевать защитное оборудование, такое как перчатки, очки и респираторы. Состав также следует хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых материалов. В случае контакта или проглатывания немедленно обратитесь за медицинской помощью.
| Символы опасности | Си (раздражает) |
| Описание безопасности | Надевайте защитные перчатки и средства защиты глаз/лица. |
| Идентификационные номера ООН | 1910 год |
| код ТН ВЭД | 2825.90.90 |
| Класс опасности | 8 – Коррозионные вещества |
| Группа упаковки | III |
| Токсичность | Гидроксид кальция обычно считается нетоксичным при правильном обращении. Однако проглатывание или вдыхание могут вызвать раздражение и ожог дыхательной системы и пищеварительного тракта. |
Методы синтеза гидроксида кальция
Синтезировать Ca(OH)2 можно различными методами.
Распространенным методом синтеза Ca(OH)2 является реакция воды с оксидом кальция , в результате чего образуется гашеная известь или гашеная известь.
Другой метод включает реакцию хлорида кальция с гидроксидом натрия. Реакция воды и углекислого газа с карбонатом кальция дает Ca(OH)2.
Процесс гидратации включает смешивание воды с оксидом кальция методом гашеной извести. В результате этой реакции в качестве побочного продукта образуется Ca(OH)2 и тепло. В процессе дополнительно удаляются примеси и лишняя вода из полученной пасты.
Метод хлорида кальция включает смешивание хлорида кальция и гидроксида натрия в процессе, называемом двойным разложением.
В результате этой реакции в качестве побочных продуктов образуются Ca(OH)2 и хлорид натрия. Полученный Ca(OH)2 затем очищают и сушат.
В методе карбоната кальция карбонат кальция сначала нагревают для получения оксида кальция и диоксида углерода. Процесс гидратации включает смешивание оксида кальция с водой, в результате чего образуется Ca(OH)2.
Использование гидроксида кальция
Ca(OH)2 находит широкое применение в различных отраслях промышленности, в том числе:
- Строительство: используется в качестве ключевого компонента при производстве бетона, строительного раствора и штукатурки благодаря своей способности укреплять и увеличивать долговечность этих материалов.
- Сельское хозяйство: используется в качестве удобрения для снижения кислотности почвы и улучшения ее плодородия.
- Очистка воды: используется для смягчения воды путем удаления примесей, таких как ионы магния и кальция.
- Химическое производство: используется при производстве различных химикатов, таких как стеарат кальция, гипохлорит кальция и фосфат кальция.
- Пищевая промышленность: используется в качестве пищевой добавки для регулирования уровня кислотности в пищевых продуктах, таких как соленые огурцы, оливки и безалкогольные напитки.
- Медицинская промышленность: используется в различных стоматологических процедурах, таких как лечение корневых каналов и пломбирование полостей, благодаря своим противомикробным и противогрибковым свойствам.
- Целлюлозно-бумажная промышленность: используется в производстве бумаги для улучшения блеска и прочности бумаги.
- Кожевенная промышленность: используется при обработке кожи для удаления волос и загрязнений.
Вопросы:
Вопрос: Растворим ли гидроксид кальция?
A: Ca(OH)2 умеренно растворим в воде, его растворимость составляет примерно 1,2 г/л при комнатной температуре.
Вопрос: Какова формула гидроксида кальция?
Ответ: Формула гидроксида кальция: Ca(OH)2.
Вопрос: Где купить гидроксид кальция рядом со мной?
О: Ca(OH)2 можно приобрести в химических, хозяйственных магазинах или в интернет-магазинах. Вы можете поискать магазины химикатов или хозяйственных товаров рядом с вашим районом или проверить интернет-магазины, такие как Amazon или eBay.
Вопрос: Ca(OH)2 – это кислота или основание?
Ответ: Ca(OH)2 является основанием. Это сильное основание, которое полностью диссоциирует в воде с образованием ионов кальция (Ca2+) и гидроксид-ионов (OH-).
Вопрос: Когда происходит реакция H3PO4(aq)+Ca(OH)2(aq)→, какова формула образующейся соли?
Ответ: Реакция между H3PO4(водн.) и Ca(OH)2(водн.) приводит к образованию фосфата кальция (Ca3(PO4)2) и воды (H2O) в виде соли и побочного продукта соответственно.
Вопрос: Растворим ли Ca(OH)2 в воде?
Ответ: Да, Ca(OH)2 умеренно растворим в воде. Он может растворяться в воде с образованием насыщенного раствора с концентрацией примерно 1,2 г/л при комнатной температуре.
Вопрос: Является ли Ca(OH)2 сильным основанием?
Ответ: Да, Ca(OH)2 является сильным основанием. Это высокоосновное соединение, которое полностью диссоциирует в воде с образованием ионов Ca2+ и OH-, что делает его сильным основанием.
Вопрос: Какие из них образуются при взаимодействии HCl с Ca(OH)2?
Ответ: Когда HCl реагирует с Ca(OH)2, образуются хлорид кальция (CaCl2) и вода (H2O), поскольку ионы H+ HCl реагируют с ионами OH- Ca(OH)2 с образованием воды, а оставшиеся ионы Ca2+ и Cl- образуют соль хлорид кальция.
