Гидразин или N2H4 — бесцветное высокореактивное соединение, состоящее из азота и водорода. Он используется в качестве ракетного топлива, в фармацевтических препаратах и сельскохозяйственных химикатах, а также в качестве восстановителя в химических реакциях.
| Название ИЮПАК | Гидразин |
| Молекулярная формула | N2H4 |
| Количество CAS | 302-01-2 |
| Синонимы | Диамин; Диазан; гидрид азота; Безводный гидразин; Безводный гидразин; гидразиния гидроксид; Гидразин гидратированный; Метилгидразин; Симметричный гидразин |
| ИнЧИ | ИнЧИ=1S/H4N2/c1-2/h2H,1H2 |
Структура Льюиса N2H4:
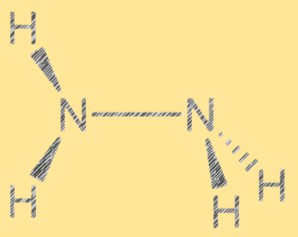
Структура Льюиса гидразина показывает расположение электронов в молекуле. Структура состоит из двух атомов азота, каждый из которых имеет пару свободных электронов, и четырех атомов водорода. Два атома азота соединены одинарной ковалентной связью, и каждый атом азота также связан с двумя атомами водорода. Структура гидразина по Льюису помогает объяснить его реакционную способность и свойства.
Название соединения N2H4:
Название соединения N2H4 – гидразин. Название происходит от того, что гидразин представляет собой соединение, содержащее атомы водорода и азота. Гидразин также известен под другими названиями, включая диамин, диазан и гидрид азота.
Молярная масса N2H4:
Молярная масса гидразина с молекулярной формулой N2H4 составляет 32,04 г/моль. Это относительно легкое соединение, состоящее из двух атомов азота и четырех атомов водорода. Низкая молярная масса гидразина является одной из причин, по которой его часто используют в качестве ракетного топлива, поскольку он обеспечивает высокую удельную тягу.
Температура кипения гидразина:
Гидразин имеет температуру кипения 113,5 ° C (236,3 ° F) при атмосферном давлении. Низкая температура кипения означает, что гидразин может легко испаряться, что может сделать обращение с ним опасным. При нагревании гидразин может разлагаться на газообразный азот и водород, что также может сделать его опасным.
Температура плавления гидразина:
Температура плавления гидразина составляет -51,7 ° C (-61,06 ° F). Это означает, что гидразин представляет собой жидкость при комнатной температуре и давлении. Его низкая температура плавления также означает, что он может легко затвердевать при более низких температурах, что может затруднить обращение с ним.
Плотность гидразина г/мл:
Плотность гидразина составляет 1,00 г/мл при комнатной температуре и давлении. Это означает, что гидразин немного плотнее воды, плотность которой в тех же условиях составляет 1,00 г/мл.
Молекулярный вес гидразина:
Молекулярная масса гидразина составляет 32,04 г/моль. Это значение используется для расчета количества гидразина, необходимого в химических реакциях и других приложениях.
Структура гидразина:
Структура гидразина состоит из двух атомов азота, связанных между собой одной ковалентной связью, причем каждый атом азота также связан с двумя атомами водорода. Это придает гидразину симметричную V-образную молекулярную структуру. Строение гидразина играет важную роль в его реакционной способности и свойствах.
Формула гидразина:
Химическая формула гидразина – N2H4. Эта формула показывает, что гидразин состоит из двух атомов азота и четырех атомов водорода. Формула используется для представления гидразина в химических уравнениях и реакциях.
| Появление | Бесцветная или бледно-желтая жидкость |
| Удельный вес | 1,00 г/мл |
| Цвет | Бесцветный |
| Запах | Запах аммиака |
| Молярная масса | 32,04 г/моль |
| Плотность | 1,00 г/мл |
| Точка плавления | -51,7°C (-61,06°F) |
| Точка кипения | 113,5°С (236,3°Ф) |
| Мигающая точка | 38°С (100°Ф) |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в этаноле, диэтиловом эфире, хлороформе. |
| Давление газа | 72 мм рт.ст. при 20°C |
| Плотность пара | 1,0 (воздух=1) |
| пКа | 8 |
| рН | Базовый (pH > 7) |
Гидразин: безопасность и опасности
Гидразин — высокореактивное и опасное соединение, требующее осторожного обращения и хранения. Он токсичен и может вызвать серьезные ожоги при попадании на кожу, в глаза или на слизистые оболочки. Вдыхание паров гидразина также может вызвать раздражение дыхательных путей, повреждение легких и в крайних случаях привести к летальному исходу. Гидразин также легко воспламеняется и может легко воспламениться, особенно при контакте с некоторыми материалами, такими как окислители. Из-за этих опасностей при работе с гидразином следует использовать соответствующие меры предосторожности и средства индивидуальной защиты, а также использовать его в хорошо вентилируемых помещениях только квалифицированными специалистами, прошедшими соответствующее обучение по технике безопасности.
| Символы опасности | Череп и скрещенные кости, пламя |
| Описание безопасности | Использовать только в хорошо проветриваемых помещениях. Надевайте перчатки, одежду и средства защиты глаз/лица. Избегайте контакта с кожей, глазами и одеждой. Беречь от тепла, искр и пламени. |
| Идентификационные номера ООН | ООН 2030 |
| код ТН ВЭД | 282510 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II |
| Токсичность | Очень токсичен при проглатывании, вдыхании и контакте с кожей. Может вызвать серьезные ожоги и повреждение тканей. Длительное воздействие может вызвать повреждение печени и почек и потенциально канцерогенно. |
Методы синтеза гидразина
Гидразин можно синтезировать различными методами в зависимости от желаемой чистоты и конкретного применения. Некоторые распространенные методы синтеза гидразина:
- Процесс Рашига: Этот метод включает реакцию аммиака и гипохлорита натрия в присутствии катализатора, такого как медь или никель.
- Процесс Олина-Рашига: Этот процесс включает реакцию мочевины и соляной кислоты с образованием гидразингидрата.
- Кетазиновый процесс. Этот процесс включает реакцию ацетона с аммиаком в присутствии катализатора, такого как никель Ренея.
- Пероксидный процесс. Этот процесс включает реакцию перекиси водорода и аммиака в присутствии катализатора, такого как платина или палладий.
- Процесс Байера: Этот процесс включает реакцию гипохлорита натрия с мочевиной в присутствии катализатора, такого как медь или никель.
- Реакция Губена-Хеша: Эта реакция включает реакцию азотистой кислоты с аммиаком в присутствии восстановителя, такого как цинк.
Каждый метод имеет свои преимущества и недостатки, и выбор метода будет зависеть от таких факторов, как стоимость, выход, чистота и безопасность. Синтез гидразина следует проводить с осторожностью, так как гидразин является опасным веществом и при неправильном обращении может представлять опасность для здоровья и безопасности человека.
Использование гидразина
N2H4 имеет широкий спектр промышленного, коммерческого и военного применения благодаря своим уникальным химическим свойствам. Некоторые распространенные применения N2H4 включают:
- Компании используют N2H4 в качестве ракетного топлива из-за его высокого энергосодержания и стабильности.
- N2H4 используется в качестве агента полимеризации при производстве некоторых полимеров, включая нейлон и кевлар.
- Химики используют N2H4 в качестве восстановителя в реакциях химического синтеза, особенно при производстве фармацевтических препаратов, пестицидов и других органических соединений.
- N2H4 действует как восстановитель в процессах металлического покрытия, особенно при никелировании.
- На водоочистных станциях N2H4 используется в качестве поглотителя кислорода, особенно в котлах и градирнях.
- Фотографы используют N2H4 в качестве проявителя фотографий, особенно при черно-белой фотографии.
- Производители автомобилей полагаются на N2H4 в качестве наполнителя в автомобильных системах подушек безопасности.
- Промышленность использует N2H4 в качестве чистящего средства для определенного оборудования и поверхностей, особенно в электронной промышленности.
Хотя гидразин имеет множество полезных применений, он также является опасным веществом, и с ним следует обращаться осторожно. При работе с гидразином следует применять надлежащие меры предосторожности и средства индивидуальной защиты. Их должны использовать только квалифицированные специалисты, прошедшие соответствующее обучение по технике безопасности.
Вопросы:
Какова степень окисления (степень окисления) N в N2H4?
В N2H4 степень окисления (степень окисления) N равна -2. Каждый атом водорода имеет степень окисления +1, а поскольку N2H4 – нейтральная молекула, сумма степеней окисления всех атомов должна равняться нулю. Поскольку в N2H4 два атома азота, общая степень окисления азота в молекуле равна -4. Следовательно, степень окисления каждого атома азота равна -2, что уравновешивает степени окисления атомов водорода.
Как называется соединение N2H4?
Соединение N2H4 обычно называют гидразином.
Каковы мольные отношения гидразина (n2h4) к перекиси водорода (h2o2) и гидразина к воде?
Мольные отношения гидразина (N2H4) к перекиси водорода (H2O2) и гидразина к воде можно определить из сбалансированных химических уравнений соответствующих реакций.
Когда гидразин реагирует с перекисью водорода, образуется газообразный азот (N2), вода (H2O) и газообразный кислород (O2) в соответствии со следующим сбалансированным уравнением:
N2H4 + H2O2 → N2 + 2H2O + O2
Согласно этому уравнению мольное соотношение гидразина и перекиси водорода составляет 1:1. Это означает, что на каждый моль гидразина, использованного в реакции, расходуется один моль перекиси водорода.
При реакции гидразина с водой образуется гидразингидрат, имеющий химическую формулу N2H4·H2O. Сбалансированное химическое уравнение этой реакции:
N2H4 + H2O → N2H4·H2O
Согласно этому уравнению мольное соотношение гидразин/вода составляет 1:1. Это означает, что на каждый моль гидразина, использованного в реакции, расходуется один моль воды и образуется один моль гидразингидрата.
