Бикарбонат натрия (NaHCO3), также известный как пищевая сода, представляет собой белый кристаллический порошок со слабым щелочным вкусом. Его обычно используют в качестве уходового средства при выпечке, в качестве чистящего средства, а также при лечении кислотного расстройства желудка и изжоги.
| Название ИЮПАК | Гидрокарбонат натрия |
| Молекулярная формула | NaHCO3 |
| Количество CAS | 144-55-8 |
| Синонимы | Пищевая сода, гидрокарбонат натрия, гидрокарбонат натрия |
| ИнЧИ | InChI=1S/CHNaO3/c2-1(3)4/h(H,2,3)(H2,1,2,3)/p-1 |
Свойства бикарбоната натрия
Молярная масса бикарбоната натрия
Молярная масса NaHCO3 составляет 84,007 г/моль. Это сумма атомных масс составляющих его элементов: натрия, водорода, углерода и кислорода.
Температура кипения бикарбоната натрия
Гидрокарбонат натрия не имеет определенной температуры кипения, поскольку он разлагается до кипячения. Температура разложения бикарбоната натрия составляет 851°C, при этом он распадается на карбонат натрия, углекислый газ и воду.
Температура плавления бикарбоната натрия
Гидрокарбонат натрия имеет температуру плавления 50°C, при которой он превращается из твердого вещества в белый кристаллический порошок.
Плотность бикарбоната натрия г/мл
Плотность гидрокарбоната натрия составляет примерно 2,165 г/мл. Эта величина может незначительно меняться в зависимости от размера зерна и степени уплотнения материала.
Молекулярный вес бикарбоната натрия
Молекулярная масса бикарбоната натрия составляет 84,007 г/моль, рассчитанная по его молекулярной формуле NaHCO3.
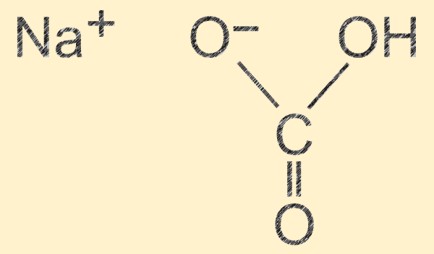
Структура бикарбоната натрия
Гидрокарбонат натрия имеет молекулярную структуру, состоящую из одного иона натрия (Na+), одного иона водорода (H+), одного иона карбоната (CO32-) и трех ионов кислорода (O2-). Ионы располагаются в повторяющейся единице, образующей кристаллическую структуру с водородной связью между молекулами. Ионная природа соединения придает ему фундаментальные свойства, а водородная связь способствует его физической стабильности.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2,165 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 84,007 г/моль |
| Плотность | 2,165 г/мл |
| Точка плавления | 50°С |
| Точка кипения | Разлагается при 851°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворим в воде |
| Растворимость | Растворим в воде |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 8.1 |
| рН | 8,1 (10 г/л, 25°С) |
Безопасность и опасность бикарбоната натрия
Бикарбонат натрия – безопасное и широко используемое соединение с низким уровнем токсичности. Обычно он считается неопасным, негорючим и невзрывоопасным. Проглатывание больших количеств может вызвать расстройство пищеварения и увеличить риск развития камней в почках. Контакт с кожей может вызвать легкое раздражение, а вдыхание пыли может вызвать раздражение дыхательных путей. Важно обращаться с NaHCO3 осторожно, чтобы избежать вдыхания пыли и контакта с кожей.
| Символы опасности | Непригодный |
| Описание безопасности | С24/25 |
| Идентификационные номера ООН | UN3077, ВЕЩЕСТВО ТВЕРДОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ, Н.У.К. (Бикарбонат натрия) |
| код ТН ВЭД | 2836.90.90 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | Низкая токсичность при проглатывании, вдыхании или контакте с кожей. |
Методы синтеза бикарбоната натрия
Бикарбонат натрия (NaHCO3) можно синтезировать несколькими методами, включая процесс Сольвея, который является наиболее часто используемым методом крупномасштабного производства. Процесс Сольвея включает реакцию хлорида натрия, аммиака и углекислого газа с образованием гидрокарбоната натрия и хлорида кальция. Гидрокарбонат натрия можно также синтезировать реакцией NaHCO3 и диоксида углерода или реакцией гидроксида натрия и диоксида углерода. Эти методы позволяют получить форму NaHCO3 высокой чистоты, которую можно дополнительно очистить перекристаллизацией.
Использование бикарбоната натрия
Гидрокарбонат натрия, широко известный как пищевая сода, благодаря своим уникальным свойствам имеет широкий спектр применения. В кулинарии его часто используют в качестве средства для ухода за выпечкой, например, тортами и хлебом. В уходе за собой он используется как мягкий абразив в зубной пасте и как дезодорант. Он также используется в пищевой промышленности в качестве регулятора pH и нейтрализующего агента. Гидрокарбонат натрия также применяется в медицинских целях, например, при лечении изжоги, расстройства желудка и повышенной кислотности. Кроме того, благодаря своим огнетушащим свойствам он используется в производстве чистящих средств и огнетушителей. Гидрокарбонат натрия также имеет экологическое применение, поскольку его можно использовать для нейтрализации кислых сточных вод.
