Бензил или C14H10O2 представляет собой желтое кристаллическое органическое соединение, используемое в качестве прекурсора в синтезе красителей и в качестве фотоинициатора в химии полимеров. Он также может действовать как восстановитель и является промежуточным продуктом при образовании бензиловой кислоты.
| Название ИЮПАК | 1,2-дифенил-1,2-дикарбоксиэтилен |
| Молекулярная формула | C14H10O2 |
| Количество CAS | 134-81-6 |
| Синонимы | 1,2-Дифенил-1,2-пропандион, 1,2-Дифенилэтандион, Бензил, Бензил |
| ИнЧИ | ИнЧИ=1S/C14H10O2/c15-13(14(16)17)11-6-8-12(9-7-11)10-5-3-1-2-4-6/h1-9H,10- 17H2 |
Бензил Молекулярный вес
Молекулярная масса бензила составляет 210,24 г/моль. Это сумма атомных масс всех атомов в молекуле бензила. Молекулярная масса бензила рассчитывается на основе его молекулярной формулы C14H10O2.
Бензил Плотность г/мл
Плотность бензила составляет 1,20 г/мл. Это измерение массы единицы объема вещества. Плотность бензила относительно низкая, что упрощает обращение с ним по сравнению с другими веществами с более высокой плотностью.
Температура кипения бензила
Температура кипения бензина составляет 350°C (662°F). Это температура, при которой давление паров жидкости равняется атмосферному давлению и жидкость превращается в пар. Температура кипения вещества зависит от различных факторов, таких как давление, молекулярная масса и межмолекулярные силы.
Точка плавления бензила
Температура плавления бензила составляет 98°C (270°F). Это температура, при которой твердое вещество превращается в жидкость. Температура плавления бензила относительно низкая, что делает его полезным промежуточным продуктом в органическом синтезе.
бензил Молярная масса
Молярная масса C14H10O2 составляет 210,24 г/моль. Это количество вещества, которое содержит то же количество объектов (например, атомов, молекул, ионов), что и количество объектов, содержащихся в 12 граммах чистого углерода-12. Молярная масса бензила рассчитывается на основе его молекулярной формулы C14H10O2.
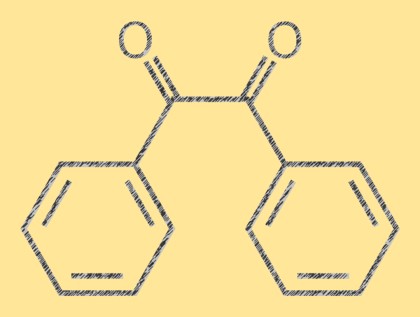
Структура бензила
Бензил — желтое кристаллическое органическое соединение с молекулярной формулой C14H10O2. Это дикетон, состоящий из двух фенильных групп, присоединенных к центральной двойной связи углерод-углерод. Молекула плоская, а двойная связь плоская. Молекула бензила имеет характерный ярко-желтый цвет, что делает ее полезной в качестве эталонного соединения в аналитической химии.
Бензиловая формула
Химическая формула бензила: C14H10O2. Он представляет собой составные элементы бензила и их относительные соотношения. Из формулы видно, что бензил состоит из 14 атомов углерода, 12 атомов водорода и 2 атомов кислорода.
Бензил ЯМР
C14H10O2 можно проанализировать методом спектроскопии ядерного магнитного резонанса (ЯМР). ЯМР-спектроскопия — мощный инструмент, предоставляющий информацию о химической структуре и взаимодействиях молекул. В ЯМР-спектроскопии магнитные свойства ядра используются для определения химического окружения ядра и получения информации о связях и химических сдвигах молекулы. Спектр ЯМР C14H10O2 предоставляет информацию о количестве протонов в молекуле и химическом окружении каждого протона, помогая подтвердить структуру C14H10O2.
| Появление | Желтое кристаллическое вещество |
| Удельный вес | 1,20 г/мл |
| Цвет | ЖЕЛТЫЙ |
| Запах | Без запаха |
| Молярная масса | 210,24 г/моль |
| Плотность | 1,20 г/мл |
| Точка плавления | 94,8°С |
| Точка кипения | 350°С (662°Ф) |
| Мигающая точка | Нет в наличии |
| Растворимость в воде | Мало растворим в воде |
| Растворимость | Растворим в этаноле и эфире |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нет в наличии |
Безопасность и опасность бензила
C14H10O2 считается умеренно токсичным веществом, и с ним следует обращаться осторожно. Он легко воспламеняется, поэтому его следует хранить вдали от источников тепла и искр. Вдыхание паров C14H10O2 может вызвать раздражение глаз, носа и горла, а также проблемы с дыханием. Контакт C14H10O2 с кожей может вызвать раздражение и покраснение кожи. Проглатывание C14H10O2 может вызвать раздражение желудка и проблемы с пищеварением. При попадании в организм в больших количествах это может привести к более серьезным проблемам со здоровьем, таким как рвота, головокружение и потеря сознания. При работе с C14H10O2 важно надевать защитные перчатки и средства защиты глаз и работать в хорошо проветриваемом помещении, чтобы свести к минимуму воздействие. При возникновении побочных реакций после контакта с C14H10O2 рекомендуется немедленно обратиться к врачу.
| Символы опасности | Легковоспламеняющийся |
| Описание безопасности | S24/25 – Избегайте контакта с кожей и глазами. |
| Идентификационные номера ООН | ООН2024 – Опасные грузы, класс опасности 3 |
| код ТН ВЭД | 2915.90.90 |
| Класс опасности | 3 – Легковоспламеняющиеся жидкости |
| Группа упаковки | III – Умеренный риск |
| Токсичность | Умеренно токсичный |
Методы синтеза бензила
C14H10O2 можно синтезировать различными методами, в том числе следующими:
- Окисление дифенилметанола: Дифенилметанол окисляется триоксидом хрома с образованием C14H10O2. Это широко используемый метод синтеза C14H10O2, поскольку он прост и экономически эффективен.
- Окисление Вакера: этот метод включает использование палладиевого катализатора и гидропероксидного окислителя для превращения алкена в C14H10O2. Реакцию обычно проводят в присутствии растворителя, такого как этанол или вода.
- Конденсация Кневенагеля. В этом методе C14H10O2 синтезируется путем реакции между бензальдегидом и барбитуровой кислотой в присутствии сильного основания, такого как гидроксид натрия или гидроксид калия.
- Реакция Ульмана: этот метод включает соединение двух ароматических соединений посредством реакции, катализируемой медью. При синтезе C14H10O2 две молекулы бензальдегида реагируют с образованием C14H10O2.
- Окисление Байера-Виллигера: В этом методе C14H10O2 синтезируется путем окисления циклогексанона до C14H10O2 в присутствии пероксикислотного окислителя и каталитического количества третичного амина.
Выбор метода синтеза C14H10O2 зависит от различных факторов, включая доступность сырья, желаемый выход и чистоту продукта, а также стоимость и время, затрачиваемые на процесс синтеза.
Использование бензила
C14H10O2 — универсальное химическое вещество, которое находит множество применений в различных областях. Некоторые из распространенных применений C14H10O2:
- В производстве тонкой химической продукции C14H10O2 используется в качестве сырья при производстве различных химикатов тонкой очистки, включая антиоксиданты, антипирены и красители.
- Синтез полимеров использует C14H10O2 при синтезе полимеров, в том числе поликарбонатов и полиуретанов, с широким спектром применения в различных отраслях промышленности.
- Пестициды используют C14H10O2 в качестве промежуточного продукта при синтезе некоторых пестицидов для борьбы с сельскохозяйственными культурами и садовыми вредителями.
- В косметике C14H10O2 используется в качестве ароматизатора в некоторых косметических продуктах, таких как духи и одеколоны, для придания свежего цветочного аромата.
- Промышленность ароматизаторов и ароматизаторов использует C14H10O2 в качестве вкусоароматического ингредиента для придания древесного и цветочного аромата пищевым и косметическим продуктам.
В заключение отметим, что C14H10O2 — универсальное химическое вещество, которое имеет широкий спектр применения в различных отраслях промышленности, включая тонкую химическую, фармацевтическую и косметическую промышленность.
Вопросы:
Бензил полярен?
Да, C14H10O2 полярен. Он имеет полярную молекулярную структуру из-за присутствия полярных функциональных групп, таких как карбонильная (-C=O) и фенильная (-C6H5) группы. Эта полярная структура делает C14H10O2 растворимым в полярных растворителях, таких как вода и спирты, но нерастворимым в неполярных растворителях, таких как углеводороды. Полярная природа C14H10O2 также позволяет ему участвовать в различных полярных реакциях, таких как водородные связи и диполь-дипольные взаимодействия.
В какой реакции происходит образование бензиловой кислоты?
Образование C14H10O2ic кислоты из C14H10O2 представляет собой тип реакции перегруппировки, известный как перегруппировка бензиловой кислоты. Эта реакция представляет собой перегруппировку карбонильной группы в C14H10O2 с образованием новой функциональной группы карбоновой кислоты в бензиловой кислоте. Перегруппировка бензиловой кислоты является примером перегруппировки Бекмана, которая представляет собой тип реакции нуклеофильного замещения, включающий перегруппировку циклических кетонов в амиды или карбоновые кислоты. Механизм реакции включает образование циклического интермедиата с последующей миграцией карбонильной группы и отщеплением уходящей группы.
