Ацетат аммония – соединение, используемое в различных отраслях промышленности. Он действует как источник ацетат-ионов и играет роль в химических реакциях и органическом синтезе.
| Название ИЮПАК | Ацетат аммония |
| Молекулярная формула | C2H7NO2 |
| Количество CAS | 631-61-8 |
| Синонимы | Аммониевая соль уксусной кислоты, этаноат аммония, уксусно-аммонийная кислота, уксусная кислота, соль аммония |
| ИнЧИ | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Свойства ацетата аммония
Формула ацетата аммония
Формула аммониевой соли уксусной кислоты: C2H7NO2. Он состоит из двух атомов углерода, семи атомов водорода, одного атома азота и двух атомов кислорода.
Молярная масса ацетата аммония
Молярную массу аммониевой соли уксусной кислоты рассчитывают путем сложения атомных масс составляющих ее элементов. Это примерно 77,0825 грамма на моль.
Температура кипения ацетата аммония
Аммониевая соль уксусной кислоты имеет температуру кипения около 117 градусов Цельсия. При этой температуре соединение претерпевает фазовый переход из жидкости в газ.
Ацетат аммония Температура плавления
Температура плавления аммониевой соли уксусной кислоты составляет примерно 114 градусов Цельсия. Это температура, при которой твердое соединение переходит в жидкое состояние.
Плотность ацетата аммония г/мл
Плотность аммониевой соли уксусной кислоты составляет примерно 1,17 грамма на миллилитр. Это мера массы единицы объема соединения.
Молекулярный вес ацетата аммония
Молекулярная масса аммониевой соли уксусной кислоты составляет примерно 77,0825 грамма на моль. Это сумма атомных весов всех атомов, присутствующих в соединении.
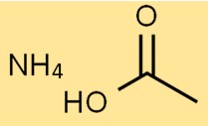
Структура ацетата аммония
Структура аммониевой соли уксусной кислоты состоит из одного иона NH4+ и одного иона CH3COO-. Ион NH4+ заряжен положительно, а ион CH3COO- отрицательно.
Растворимость ацетата аммония
Аммониевая соль уксусной кислоты хорошо растворима в воде. Он легко растворяется в воде, образуя прозрачный бесцветный раствор. Растворимость аммониевой соли уксусной кислоты в воде обусловлена ее способностью образовывать водородные связи с молекулами воды.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1,17 г/мл |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 77,0825 г/моль |
| Плотность | 1,17 г/мл |
| Точка плавления | 114°С |
| Точка кипения | 117°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | очень растворим в воде |
| Растворимость | Растворим в воде, уксусной кислоте, этаноле. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | 4,75 |
| рН | Около 6,0-7,0 |
Безопасность и опасность ацетата аммония
Аммониевая соль уксусной кислоты при правильном обращении представляет минимальную угрозу безопасности. Его использование обычно считается безопасным в различных приложениях. Однако, как и в случае с любыми химическими веществами, необходимо соблюдать меры предосторожности. Избегайте вдыхания пыли и паров, так как это может вызвать раздражение дыхательных путей. При работе с аммонийной солью уксусной кислоты желательно носить соответствующие средства индивидуальной защиты, в том числе перчатки и защитные очки. При случайном проглатывании или попадании в глаза или на кожу промойте большим количеством воды и при необходимости обратитесь к врачу. Храните аммонийную соль уксусной кислоты в сухом, прохладном месте, вдали от несовместимых веществ. Для обеспечения безопасности соблюдайте надлежащие процедуры обращения и утилизации.
| Символы опасности | Никто |
| Описание безопасности | Низкая токсичность |
| Идентификационные номера ООН | Не регулируется |
| код ТН ВЭД | 2915.29.10 |
| Класс опасности | Аммонийная соль уксусной кислоты не классифицируется |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность |
Методы синтеза ацетата аммония
Существует несколько методов синтеза аммониевой соли уксусной кислоты. Распространенный подход заключается в смешивании уксусной кислоты с водным раствором карбоната аммония . В результате реакции между ними образуется соль аммония и уксусная вода. Этот метод требует контроля температуры и давления во время реакции.
В другом методе химики постепенно добавляют уксусную кислоту в раствор аммиака при перемешивании, пока не будет достигнут желаемый pH. Этот процесс нейтрализации превращает уксусную кислоту в аммониевую соль уксусной кислоты. Во время этой реакции необходимо тщательное перемешивание и контроль pH.
Используйте гидроксид аммония для синтеза аммониевой соли уксусной кислоты путем соединения ее с уксусной кислотой , в результате чего образуется аммонийная соль уксусной кислоты и воды. Следите за ходом этой реакции до ее завершения.
Смешайте уксусный ангидрид с гидроксидом аммония или аммиаком, чтобы получить аммонийную соль уксусной кислоты. Реакция между этими реагентами приводит к образованию аммониевой соли уксусной кислоты.
Помните, что синтез аммониевой соли уксусной кислоты необходимо проводить в хорошо проветриваемом помещении и соблюдать соответствующие меры безопасности. На протяжении всего процесса синтеза обеспечьте правильное обращение и хранение химикатов.
Использование ацетата аммония
Аммонийная соль уксусной кислоты находит разнообразное применение в различных отраслях промышленности благодаря своим универсальным свойствам. Вот некоторые распространенные варианты использования:
- Аммониевая соль уксусной кислоты буферизирует растворы и поддерживает стабильный уровень pH в химических и биологических лабораториях.
- Аналитические методы, такие как хроматография и масс-спектрометрия, используют аммониевую соль уксусной кислоты в качестве реагента для ионизации и разделения соединений.
- Молекулярная биология использует аммониевую соль уксусной кислоты для осаждения ДНК во время процедур очистки, тем самым удаляя загрязнения и примеси.
- Аммониевая соль уксусной кислоты участвует во многих химических реакциях, выступая источником ацетат-ионов в органическом синтезе, реакциях этерификации и каталитических процессах.
- В сельском хозяйстве аммонийная соль уксусной кислоты служит источником азота в удобрениях, способствующих росту и развитию растений.
- Текстильная промышленность использует аммониевую соль уксусной кислоты для окрашивания и печати на тканях, тем самым улучшая стойкость цвета за счет закрепления красителей на ткани.
- Пищевая промышленность одобрила аммонийную соль уксусной кислоты в качестве пищевой добавки, регулирующей кислотность для контроля pH различных пищевых продуктов.
- В методах химического анализа, таких как ВЭЖХ (высокоэффективная жидкостная хроматография), аммониевая соль уксусной кислоты облегчает разделение и обнаружение соединений.
В целом, аммонийная соль уксусной кислоты представляет собой универсальное соединение, которое можно использовать в самых разных областях: от лабораторных исследований до сельского хозяйства и пищевой промышленности. Его уникальные свойства делают его важным ингредиентом в различных процессах и продуктах.
Вопросы:
Вопрос: Сколько атомов водорода содержится в молекуле ацетата аммония NH4C2H3O2?
Ответ: В одной молекуле аммониевой соли уксусной кислоты (NH4C2H3O2) четыре атома водорода.
Вопрос: Растворим ли ацетат аммония?
Ответ: Да, аммонийная соль уксусной кислоты растворима в воде.
Вопрос: Какова формула ацетата аммония?
Ответ: Формула аммониевой соли уксусной кислоты: NH4C2H3O2.
Вопрос: Растворяется ли ацетат аммония в воде?
Ответ: Да, аммонийная соль уксусной кислоты растворима в воде.
Вопрос: Как приготовить 1М ацетат аммония?
A: Чтобы приготовить 1М аммонийную соль уксусной кислоты, растворите соответствующее количество ацетата аммония в воде до концентрации 1 моль на литр (М).
Вопрос: Сколько всего молей ионов высвобождается при растворении в воде 0,624 моля ацетата аммония?
Ответ: При растворении в воде 0,624 моля аммонийной соли уксусной кислоты всего выделяется 1,248 моля ионов (NH4+ и C2H3O2-).
Вопрос: Какова точная молекулярная масса ацетата аммония (NH4OAc)?
A: Точная молекулярная масса аммониевой соли уксусной кислоты (NH4OAc) составляет примерно 77,0825 грамма на моль.
Вопрос: Как сделать ацетат аммония 5М?
A: Чтобы получить 5М аммонийную соль уксусной кислоты, растворите соответствующее количество ацетата аммония в воде до концентрации 5 молей на литр (М).
Вопрос: Какова pKa уксусной кислоты и pKb гидроксида аммония?
Ответ: pKa уксусной кислоты составляет примерно 4,75, а pKb аммониевой соли уксусной кислоты составляет примерно 4,25.
