Метанол (CH3OH) — бесцветная легковоспламеняющаяся жидкость со сладким запахом. Используется в качестве растворителя, топлива и антифриза. При проглатывании он может быть токсичным и вызвать слепоту или смерть.
| Название ИЮПАК | Метанол |
| Молекулярная формула | СН4О |
| Количество CAS | 67-56-1 |
| Синонимы | Метиловый спирт, древесный спирт, гидроксиметан, карбинол, древесная нафта, колониальный спирт. |
| ИнЧИ | ИнХI=1S/CH4O/c1-2/h2H,1H3 |
Примечание. InChI представляет собой длинную цепь, представляющую уникальную структуру молекулы. На некоторых устройствах оно может отображаться неправильно.
Свойства метанола
Метанол Молярная масса
Молярная масса метанола составляет 32,04 г/моль. Он рассчитывается путем сложения атомных масс атомов углерода, водорода и кислорода в одной молекуле метанола. Это значение полезно для определения количества метанола, необходимого для приготовления раствора определенной концентрации, или для определения стехиометрии химической реакции.
Температура кипения метанола
Метанол имеет температуру кипения 64,7°C (148,46°F). Эта относительно низкая температура кипения делает метанол полезным в качестве растворителя в различных отраслях промышленности, включая производство формальдегида, уксусной кислоты и метилметакрилата. Однако низкая температура кипения метанола также делает его летучим и легковоспламеняющимся, что может представлять угрозу безопасности при хранении, погрузочно-разгрузочных работах и транспортировке.
Температура плавления метанола
CH3OH имеет температуру плавления -97,6°C (-143,68°F). Это означает, что CH3OH при комнатной температуре является жидкостью, но его можно легко заморозить в твердую форму, охладив его ниже температуры плавления. Низкая температура плавления CH3OH также полезна в некоторых лабораторных применениях, например, при приготовлении криогенных растворителей для спектроскопии ядерного магнитного резонанса.
Плотность метанола г/мл
Плотность CH3OH составляет 0,792 г/мл при 20°C (68°F). Это означает, что CH3OH менее плотен, чем вода, и может плавать на ней. Плотность CH3OH также можно использовать для расчета объема CH3OH, необходимого для получения определенной массы или концентрации раствора.
Молекулярный вес метанола
Молекулярная масса CH3OH составляет 32,04 г/моль. Это значение рассчитывается путем сложения атомных масс атомов углерода, водорода и кислорода в одной молекуле CH3OH. Молекулярная масса CH3OH полезна при определении его физических свойств, таких как температура кипения, температура плавления и плотность.
Структура метанола
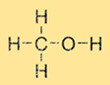
Метанол имеет простую структуру, состоящую из метильной группы (СН3) и гидроксильной группы (-ОН), присоединенных к одному атому углерода. Молекулярная формула метанола – CH3OH. Метанол является полярной молекулой из-за наличия гидроксильной группы, что делает его растворимым в полярных растворителях, таких как вода и этанол.
Формула метанола
Химическая формула метанола – CH3OH. Это означает, что каждая молекула метанола содержит один атом углерода, четыре атома водорода и один атом кислорода. Формулу метанола можно использовать для определения молекулярной массы и других физических свойств метанола. Химическая формула метанола также полезна для написания химических уравнений и балансировки химических реакций с участием метанола.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,792 г/мл при 20°С |
| Цвет | Бесцветный |
| Запах | Сладкий, пряный |
| Молярная масса | 32,04 г/моль |
| Плотность | 0,792 г/мл при 20°С |
| Точка плавления | -97,6°С |
| Точка кипения | 64,7°С |
| Мигающая точка | 11,1°С |
| Растворимость в воде | смешивается |
| Растворимость | Смешивается с этанолом, эфиром, ацетоном и многими органическими растворителями. |
| Давление газа | 13,02 кПа при 20°C |
| Плотность пара | 1,11 (воздух = 1) |
| пКа | 15,5 |
| рН | 7 (нейтральный) |
Примечание. Значения, указанные в этой таблице, являются приблизительными и могут варьироваться в зависимости от конкретных условий и источников метанола.
Безопасность и опасность метанола
CH3OH представляет различные риски для безопасности, и с ним следует обращаться с осторожностью. Это легковоспламеняющаяся жидкость, которая может воспламениться при воздействии тепла, искр или пламени. Пары CH3OH также могут образовывать с воздухом взрывоопасные смеси. Вдыхание паров CH3OH может вызвать головокружение, головные боли, тошноту и другие проблемы со здоровьем. CH3OH также токсичен и может впитываться через кожу или проглатываться, вызывая серьезные осложнения для здоровья, включая слепоту, кому и смерть. Важно носить защитную одежду и работать с CH3OH в хорошо проветриваемом помещении, используя соответствующие средства защиты, такие как очки, перчатки и респиратор. Разливы следует немедленно убирать и утилизировать надлежащим образом.
| Символы опасности | Череп и скрещенные кости, легковоспламеняющиеся |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Используйте взрывозащищенное электро/вентиляционное/осветительное оборудование. Держите контейнер плотно закрытым. Наземный/подручный контейнер и приемное оборудование. Используйте только искробезопасные инструменты. Примите меры предосторожности против статического разряда. Избегайте вдыхания паров. Тщательно промойте после обработки. Не ешьте, не пейте и не курите во время использования этого продукта. |
| Идентификаторы сети | ООН1230 |
| код ТН ВЭД | 29051100 |
| Класс опасности | 3 |
| Группа упаковки | II |
| Токсичность | Метанол токсичен и может вызвать слепоту, кому и смерть при проглатывании, вдыхании или попадании через кожу. Он также может вызвать раздражение, покраснение и ожоги при контакте. Воздействие паров метанола может вызвать головные боли, головокружение, тошноту и другие проблемы со здоровьем. С метанолом следует обращаться с особой осторожностью и с использованием соответствующих защитных средств. |
Примечание. Значения, указанные в этой таблице, являются приблизительными и могут варьироваться в зависимости от конкретных условий и источников метанола. При обращении с метанолом важно соблюдать паспорт безопасности и действующие правила.
Методы синтеза метанола
Прямое окисление метана, частичное окисление природного газа, газификация угля и синтез из углекислого газа и водорода — все они синтезируют метанол.
Одним из наиболее распространенных методов синтеза метанола является каталитическая конверсия синтез-газа, который представляет собой смесь оксида углерода, диоксида углерода и водорода. Этот процесс включает использование катализатора, обычно на основе меди, для облегчения реакции. Сингаз вводится в реактор, содержащий катализатор, при высоких температурах и давлениях, в результате чего образуется метанол.
Другой метод синтеза метанола включает прямое окисление метана, что предполагает использование высоких температур и давлений в присутствии катализатора, такого как платина или палладий. Этот метод сложнее и дороже, чем метод синтез-газа, но он более эффективен и может давать более высокие выходы.
Частичное окисление природного газа — еще один метод синтеза метанола, который предполагает использование кислорода или воздуха для частичного окисления природного газа с образованием смеси окиси углерода и водорода. Затем смесь вводят в реактор, содержащий катализатор, в результате чего образуется метанол.
Газификация угля — это еще один метод синтеза метанола, который включает преобразование угля в синтез-газ с последующим тем же процессом каталитической конверсии, который описан выше.
Улавливание и утилизация углерода преобразуют выбросы углекислого газа в результате промышленных процессов в метанол с использованием водорода в качестве восстановителя.
Использование метанола
Метанол имеет широкий спектр применения в различных отраслях промышленности, в том числе:
- Топливо: Транспортные средства, генераторы и другое промышленное оборудование могут использовать метанол в качестве топлива.
- Растворитель: Метанол является отличным растворителем для многих веществ, включая смолы, красители и масла. Производители используют метанол для производства красок, лаков и других покрытий.
- Химический промежуточный продукт: используется в качестве сырья для производства формальдегида, уксусной кислоты и других химикатов.
- Антифриз: используется в качестве антифриза в автомобильных системах охлаждения.
- Противообледенительный агент: используется в качестве противообледенительного средства для крыльев самолетов и взлетно-посадочных полос аэропортов.
- Очиститель: используется в качестве чистящего средства в различных промышленных процессах.
- Фармацевтика: используется в качестве растворителя при производстве многих фармацевтических продуктов.
- Альтернативная энергия: изучается как альтернативное топливо для топливных элементов и как потенциальный носитель энергии.
- Метанол в олефины (МТО): олефины, такие как этилен и пропилен, получаются в результате конверсии метанола.
- Метанол в бензин (MTG): процесс под названием MTG превращает метанол в бензин.
Вопросы:
Вопрос: Что такое метанол?
Ответ: Метанол, также известный как древесный спирт, представляет собой бесцветную легковоспламеняющуюся жидкость со сладким запахом. Это простейший спирт, его химическая формула CH3OH.
Вопрос: Метанол полярный или неполярный?
Ответ: Метанол — полярная молекула. Он имеет положительный частичный заряд на атомах водорода и отрицательный частичный заряд на атоме кислорода, что приводит к дипольному моменту.
Вопрос: Для чего используется метанол?
Ответ: Метанол имеет широкий спектр применения в различных отраслях промышленности, в том числе в качестве топлива, растворителя, промежуточного химического продукта, антифриза, антиобледенителя, очистителя, фармацевтического растворителя и потенциального носителя энергии. Он также используется в производстве формальдегида, уксусной кислоты и других химических веществ. Кроме того, метанол преобразуется в олефины, такие как этилен и пропилен, которые используются в качестве сырья для производства пластмасс.
