Сульфат кальция (CaSO4) представляет собой белый порошок, встречающийся в природе или производимый промышленным способом. Он используется в строительстве, пищевой промышленности и медицине благодаря своим свойствам связующего, наполнителя и питательного вещества.
| Название ИЮПАК | Сульфат кальция |
| Молекулярная формула | CaSO4 |
| Количество CAS | 7778-18-9 |
| Синонимы | Гипс, безводный гипс, ангидрит, дигидрат, соль кальция, селенит |
| ИнЧИ | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Свойства сульфата кальция
Формула сульфата кальция
Химическая формула сульфата кальция — CaSO4. Это означает, что каждая молекула сульфата кальция содержит один атом кальция, один атом серы и четыре атома кислорода. Формула используется для представления состава сульфата кальция в химических уравнениях и для расчета количества реагентов, необходимых в химических реакциях.
Молярная масса сульфата кальция
Молярная масса CaSO4 составляет примерно 136,14 г/моль. Это значение рассчитывается путем сложения атомных масс одного атома кальция, одного атома серы и четырех атомов кислорода в соединении. Молярная масса используется для определения количества CaSO4, необходимого в химических реакциях, и для расчета его концентрации в растворах.
Температура кипения сульфата кальция
CaSO4 не имеет определенной температуры кипения, поскольку до достижения точки кипения он подвергается термическому разложению. Однако его можно нагревать до температуры выше 200°C без разложения. При более высоких температурах CaSO4 подвергается эндотермическому разложению с образованием оксида кальция и триоксида серы.
Температура плавления сульфата кальция
Температура плавления CaSO4 зависит от состояния его гидратации. Безводная форма CaSO4 имеет температуру плавления около 1460°C, тогда как дигидратная форма имеет более низкую температуру плавления примерно 128°C. Формы полугидрата и тригидрата имеют промежуточные температуры плавления.
Плотность сульфата кальция г/мл
Плотность CaSO4 зависит от его формы и состояния гидратации. Безводная форма CaSO4 имеет плотность примерно 2,96 г/мл, а дигидратная форма — примерно 2,32 г/мл. Гемигидратные и тригидратные формы имеют промежуточную плотность.
Молекулярный вес сульфата кальция
Молекулярная масса CaSO4 составляет примерно 136,14 г/моль. Это значение рассчитывается путем сложения атомных масс одного атома кальция, одного атома серы и четырех атомов кислорода в соединении. Молекулярная масса используется для расчета количества CaSO4, необходимого в химических реакциях, и для определения его концентрации в растворах.
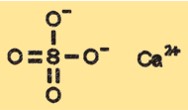
Структура сульфата кальция
CaSO4 имеет кристаллическую структуру, которая может меняться в зависимости от состояния гидратации. Безводная форма CaSO4 имеет кристаллическую структуру, классифицируемую как ромбическую, тогда как дигидратная форма имеет моноклинную кристаллическую структуру. Формы полугидрата и тригидрата имеют разные кристаллические структуры, которые являются промежуточными между безводными и дигидратными формами.
| Появление | Белый или твердый порошок |
| Удельный вес | 2,96 (безводный), 2,32 (дигидрат) |
| Цвет | Белый или бесцветный |
| Запах | Без запаха |
| Молярная масса | 136,14 г/моль |
| Плотность | 2,96 г/см³ (безводный), 2,32 г/см³ (дигидрат) |
| Точка плавления | 1460°С (безводный), 128°С (дигидрат) |
| Точка кипения | Не имеет определенной точки кипения. |
| Мигающая точка | Непригодный |
| Растворимость в воде | 0,24 г/100 мл (20°С) |
| Растворимость | Растворим в воде и глицерине, нерастворим в этаноле. |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | 9,8 (первая диссоциация), 11,8 (вторая диссоциация) |
| рН | 7 (нейтральный) |
Безопасность и опасность сульфата кальция
CaSO4 обычно считается безопасным в использовании и обращении, но при неправильном обращении он может представлять определенный риск для здоровья. Вдыхание пыли CaSO4 может вызвать раздражение дыхательной системы, а проглатывание большого количества соединения может вызвать расстройство желудочно-кишечного тракта. Контакт CaSO4 с глазами и кожей может вызвать раздражение или сухость. CaSO4 также может вступать в реакцию с некоторыми химическими веществами с образованием опасных побочных продуктов. Поэтому при работе с CaSO4 следует носить соответствующие средства индивидуальной защиты и хранить их в прохладном, сухом, хорошо вентилируемом помещении вдали от несовместимых материалов.
| Символы опасности | Никто |
| Описание безопасности | Вред при проглатывании. Вызывает раздражение кожи и глаз. |
| Идентификационные номера ООН | Не регулируется |
| код ТН ВЭД | 2833.29.00 |
| Класс опасности | Не классифицируется как опасное вещество или смесь согласно Регламенту (ЕС) № 1272/2008 [CLP]. |
| Группа упаковки | Непригодный |
| Токсичность | LD50 (перорально, крыса): > 2000 мг/кг |
Методы синтеза сульфата кальция
Несколько методов позволяют синтезировать CaSO4 в зависимости от желаемой формы и состояния гидратации соединения.
Распространенным методом является взаимодействие карбоната или оксида кальция с серной кислотой. В результате реакции образуются CaSO4 и углекислый газ или вода соответственно.
Другой метод включает реакцию хлорида кальция с сульфатом натрия , в результате которой выпадает CaSO4. Термическая дегидратация гипса, природной минеральной формы дигидрата CaSO4, приводит к образованию CaSO4.
Некоторые промышленные процессы, такие как десульфуризация дымовых газов электростанций, производят CaSO4 в качестве побочного продукта. Во время этого процесса диоксид серы реагирует с карбонатом кальция с образованием сульфита кальция, который подвергается окислению с образованием CaSO4.
Метод синтеза, используемый для CaSO4, может влиять на его свойства, такие как размер частиц, кристалличность и чистота. Поэтому важно выбрать метод, соответствующий предполагаемому применению соединения.
Использование сульфата кальция
CaSO4 имеет множество применений в различных отраслях промышленности благодаря своим уникальным свойствам, включая низкую токсичность, высокую температуру плавления и белый цвет. Некоторые распространенные применения CaSO4 включают:
- Строительство: Ключевой компонент цемента и гипсокартона, где он действует как связующее вещество и замазка.
- Продукты питания и напитки: используется в качестве коагулянта при производстве тофу и в качестве укрепляющего агента в некоторых сырах и овощных консервах.
- Фармацевтика: используется в качестве наполнителя и связующего при производстве таблеток и капсул.
- Сельское хозяйство: используется в качестве удобрения для улучшения структуры почвы и повышения урожайности.
- Химические вещества: используются в производстве различных химикатов, таких как пигменты, обработка бумаги и текстиля.
- Косметика: используется в косметических рецептурах в качестве наполнителя и матирующего агента.
- Водоочистка: используется при очистке воды для удаления примесей и уменьшения накипи.
- Пластмассы и резина: используется в качестве наполнителя и армирующего агента в пластмассовых и резиновых изделиях.
Вопросы:
Вопрос: Является ли сульфат кальция веганским?
Ответ: Да, CaSO4 считается веганским, поскольку он не имеет животного происхождения.
Вопрос: Каково основное применение сульфата кальция в больницах?
Ответ: CaSO4 обычно использовался в больницах в качестве гипсовой повязки при переломах костей.
Вопрос: Каковы массы сульфата кальция и фосфора?
Ответ: Этот вопрос неполный и требует дополнительной информации для конкретного ответа.
Вопрос: Растворим ли CaSO4 в воде?
Ответ: CaSO4 плохо растворяется в воде, его растворимость составляет примерно 2,05 г/л при комнатной температуре.
Вопрос: Растворим ли CaSO4?
Ответ: Сульфат кальция плохо растворяется в воде, его растворимость составляет примерно 2,05 г/л при комнатной температуре.
Вопрос: Какова молярная масса CaSO4?
A: Молярная масса CaSO4 составляет примерно 136,14 г/моль.
Вопрос: Какая соль имеет pH <7? KBr, HCOOK, CaSO4, NH4NO3
Ответ: Ни одна из перечисленных солей не имеет pH < 7 в чистом виде. Однако при растворении в воде NH4NO3 (нитрат аммония) образует кислый раствор с pH < 7.
