Нитробензол или C6H5NO2 — органическое соединение бледно-желтого цвета и отчетливого запаха. Он используется в качестве прекурсора для производства анилина и других химических веществ. Это также токсичное вещество.
| Название ИЮПАК | Нитробензол |
| Молекулярная формула | C6H5NO2 |
| Количество CAS | 98-95-3 |
| Синонимы | Нитробензол, Нитробензол, Мирбейн Эссенция, NB |
| ИнЧИ | ИнЧИ=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
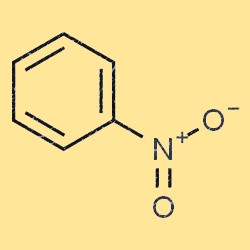
Структура нитробензола
Нитробензол имеет плоскую молекулярную структуру. Он состоит из бензольного кольца (C6H5) с нитрогруппой (-NO2), присоединенной к одному из атомов углерода. Нитрогруппа является электроноакцепторной группой, то есть снижает электронную плотность бензольного кольца. Это свойство делает нитробензол менее реакционноспособным, чем бензол, во многих химических реакциях.
Формула нитробензола
Химическая формула нитробензола: C6H5NO2. Эта формула представляет количество и тип атомов, составляющих молекулу. Бензольное кольцо составляет основу молекулы, а нитрогруппа представляет собой полярную функциональную группу, которая влияет на свойства соединения. Формула нитробензола важна для понимания его химических и физических свойств, а также его реакционной способности с другими веществами.
Молярная масса of нитробензол
Молярная масса нитробензола, также называемого C6H5NO2, составляет 123,11 г/моль. Это рассчитывается путем сложения атомных масс всех атомов соединения. Нитробензол имеет относительно высокую молярную массу из-за присутствия в его химической структуре шести атомов углерода и одного атома азота.
Температура кипения нитробензола
Нитробензол имеет температуру кипения 210,9°С. Это относительно высокий показатель по сравнению с другими органическими соединениями с аналогичной молекулярной массой. Высокая температура кипения обусловлена наличием сильных межмолекулярных сил притяжения между молекулами нитробензола, таких как водородные связи и диполь-дипольные взаимодействия.
Температура плавления нитробензола
Температура плавления нитробензола составляет 5,85°С. Это сравнительно низкая температура по сравнению с температурой его кипения, что можно объяснить тем, что межмолекулярные силы притяжения в твердом состоянии слабее, чем в жидком. Кроме того, нитробензол может проявлять полиморфизм, то есть он может существовать в нескольких кристаллических структурах с разными температурами плавления.
Плотность нитробензола г/мл
Плотность нитробензола составляет 1,20 г/мл при комнатной температуре (25°С). Это означает, что нитробензол плотнее воды, плотность которой при той же температуре составляет 1 г/мл. На плотность нитробензола влияют его молекулярная масса, а также размер и форма его молекул.
Молекулярный вес нитробензола
Молекулярная масса нитробензола составляет 123,11 г/моль. Это рассчитывается путем сложения атомных масс всех атомов соединения. Молекулярная масса нитробензола важна для определения его физических и химических свойств, таких как температура кипения, температура плавления и растворимость.
| Появление | Бледно-желтая жидкость |
| Удельный вес | 1,20 г/см3 |
| Цвет | Бледно-желтый |
| Запах | Характеристика |
| Молярная масса | 123,11 г/моль |
| Плотность | 1,20 г/мл при 25°C |
| Точка плавления | 5,85°С |
| Точка кипения | 210,9°С |
| Мигающая точка | 77°С |
| Растворимость в воде | 7,9 г/л при 25°C |
| Растворимость | Растворим в органических растворителях |
| Давление газа | 0,68 мм рт.ст. при 25°C |
| Плотность пара | 4,35 (воздух=1) |
| пКа | -1,15 |
| рН | 7 (нейтральный) |
Безопасность и опасность нитробензола
Нитробензол — высокотоксичное вещество, представляющее ряд рисков для безопасности и здоровья. Он может вызвать раздражение кожи, глаз и дыхательных путей при контакте или вдыхании. Длительное воздействие нитробензола может вызвать повреждение печени и почек, анемию и метгемоглобинемию. Нитробензол также очень легко воспламеняется и может воспламениться при относительно низких температурах. Кроме того, он может выделять токсичные пары при нагревании, сжигании или разложении. Поэтому важно обращаться с нитробензолом осторожно, носить соответствующие защитные средства и хранить его в прохладном, сухом месте, вдали от источников возгорания и несовместимых веществ.
| Символы опасности | Т, Н |
| Описание безопасности | Очень токсичен, вреден при проглатывании, вдыхании или попадании через кожу, вызывает серьезные ожоги кожи и повреждения глаз. |
| Идентификаторы сети | ООН1662 |
| код ТН ВЭД | 2904.90.90 |
| Класс опасности | 6.1 |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза нитробензола
Нитробензол можно синтезировать несколькими методами, включая нитрование бензола, восстановление нитробензола и гидрирование нитробензола. Наиболее распространенным методом является нитрование бензола, заключающееся в реакции бензола со смесью азотной и серной кислот при температуре около 50°С. Реакция нитрования дает смесь нитробензола, а также других нитропроизводных бензола.
Другим методом синтеза нитробензола является восстановление нитробензола, которое включает использование восстановителей, таких как железо или цинк и соляная кислота. Реакция восстановления преобразует нитрогруппу (-NO2) нитробензола в аминогруппу (-NH2), образуя анилин в качестве побочного продукта.
Гидрирование нитробензола — еще один метод синтеза анилина. Этот метод включает использование катализатора, такого как никель или палладий, и газообразного водорода, который реагирует с нитробензолом с образованием анилина.
Использование нитробензола
Нитробензол — универсальное химическое вещество, используемое в широком спектре применений.
- Химическая промышленность использует нитробензол в качестве прекурсора анилина, важного ингредиента в производстве красителей, каучука и фармацевтических препаратов. Нитробензол является ценным сырьем для производства других химикатов, таких как фенол, используемых в производстве пластмасс, смол и клеев.
- Органические соединения, такие как масла, жиры и воски, можно растворять с помощью нитробензола, что делает его полезным растворителем. В пищевой промышленности нитробензол используется как ароматизатор, главным образом при производстве жевательной резинки.
- C6H5NO2 является важным компонентом при производстве взрывчатых веществ, таких как тротил (тринитротолуол). В качестве топливной присадки нитробензол способствует повышению октанового числа бензина.
- C6H5NO2 также используется при производстве различных пестицидов и гербицидов, в том числе инсектицидов и фунгицидов.
- Производство синтетических волокон, таких как нейлон, также основано на нитробензоле как важном компоненте.
В целом, универсальная природа нитробензола делает его незаменимым химическим веществом во многих отраслях промышленности, включая химическую, пищевую и текстильную. Однако при использовании нитробензола необходимы правильное обращение и меры предосторожности из-за его токсичности и воспламеняемости.
Вопросы:
Реакция нитробензола с анилином
Превращение нитробензола в анилин представляет собой двухстадийную реакцию, включающую восстановление нитрогруппы (-NO2) до аминогруппы (-NH2) и последующий гидролиз промежуточного продукта.
Восстановление C6H5NO2 обычно осуществляется с использованием восстановителя, такого как железо или цинк, и кислого раствора, такого как соляная кислота. В результате реакции образуется промежуточный продукт нитрозобензол, который затем восстанавливается до анилина в присутствии кислотного или основного катализатора.
Гидролиз промежуточного нитрозобензола до анилина осуществляется путем обработки промежуточного продукта кислотным раствором, например разбавленной соляной кислотой. В результате реакции образуется анилин, а также вода и оксид азота (NO).
Общую реакцию можно представить следующим образом: Нитробензол + 3 H2 → Анилин + 2 H2O + N2.
