Этанол или C2H6O — бесцветный, легковоспламеняющийся спирт, полученный из растительного сырья, часто используемый в качестве биотоплива или растворителя. Это также распространенный ингредиент алкогольных напитков.
| Название ИЮПАК | Спирт этиловый |
| Молекулярная формула | C2H6O |
| Количество CAS | 64-17-5 |
| Синонимы | Этиловый спирт, зерновой спирт, EtOH, спирт |
| ИнЧИ | ИнХИ=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Свойства этанола
Структура Льюиса C2H6O
Структуру Льюиса C2H6O (также известного как этанол) можно нарисовать следующим образом:
ХХ
| |
HCCOH
| |
ХХ
В этой структуре два атома углерода связаны друг с другом одинарной ковалентной связью. Каждый атом углерода также связан с тремя атомами водорода, а один атом углерода связан с одним атомом кислорода. Атом кислорода связан с атомом углерода одинарной ковалентной связью и имеет две пары свободных электронов.
Эта структура удовлетворяет правилу октетов, которое гласит, что каждый атом в молекуле должен иметь восемь электронов в своей валентной оболочке. Атомы углерода имеют четыре электрона в валентной оболочке, а атомы водорода — по одному электрону. Атом кислорода имеет шесть валентных электронов и с двумя дополнительными неподеленными парами удовлетворяет правилу октетов.
C2H6O Молярная масса
Этанол имеет молярную массу примерно 46,07 г/моль. Молярная масса вещества определяется как масса одного моля этого вещества. В случае с этанолом один моль этанола содержит примерно 46,07 грамма вещества. Молярная масса — полезный параметр в химических расчетах, поскольку она позволяет конвертировать массу вещества в моли.
Температура кипения этанола
Этанол имеет температуру кипения примерно 78,5°C (173,3°F) при стандартном давлении. Эта относительно низкая температура кипения облегчает испарение этанола, который полезен во многих промышленных процессах. Например, этанол обычно используется в качестве растворителя при производстве фармацевтических препаратов, парфюмерии и других химических веществ.
Температура плавления этанола
Этанол имеет температуру плавления примерно -114,1°C (-173,4°F). Эта низкая температура плавления делает этанол жидким при комнатной температуре, поэтому его обычно используют в жидкой форме в качестве растворителя или топлива. Температура плавления этанола ниже, чем у воды, что позволяет использовать этанол в качестве антифриза в системах охлаждения автомобилей.
Плотность этанола г/мл
Плотность этанола составляет примерно 0,789 г/мл при стандартной температуре и давлении. Это означает, что один миллилитр этанола весит 0,789 грамма. Плотность этанола ниже, чем у воды, плотность которой составляет 1 г/мл при стандартных температуре и давлении. Это означает, что этанол будет плавать на поверхности воды.
Этанол Молекулярный вес
Молекулярная масса этанола составляет примерно 46,07 г/моль. Молекулярная масса – это сумма атомных весов всех атомов молекулы. В случае этанола он содержит два атома углерода, шесть атомов водорода и один атом кислорода. Молекулярная масса используется для расчета количества молей вещества в данной массе вещества.
Структура этанола
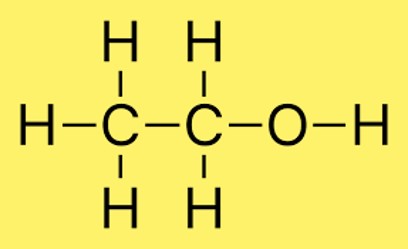
В структуре этанола два атома углерода связаны одинарной связью, а три атома водорода связаны с каждым атомом углерода. Кроме того, атом водорода связан с атомом кислорода. Расположение атомов в молекуле обычно обозначается CH3CH2OH.
Формула этанола
Химическая формула этанола: C2H6O. Эта формула показывает количество и тип атомов в молекуле. Формулу можно использовать для расчета молекулярной массы этанола, а также количества молей этанола в данной массе вещества. Формула также полезна для прогнозирования химического поведения этанола в реакциях с другими химическими веществами.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,789 |
| Цвет | Бесцветный |
| Запах | Характерный запах |
| Молярная масса | 46,07 г/моль |
| Плотность | 0,789 г/мл |
| Точка плавления | -114,1°C (-173,4°F) |
| Точка кипения | 78,5°C (173,3°F) при стандартном давлении |
| Мигающая точка | 13°С (55°Ф) |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в полярных и неполярных растворителях. |
| Давление газа | 44,6 кПа при 20°C |
| Плотность пара | 1,59 (воздух = 1) |
| пКа | от 15,9 до 25°С |
| рН | 7 (нейтральный) |
Безопасность и опасность этанола
Этанол является легковоспламеняющейся жидкостью и при неправильном обращении может представлять опасность пожара и взрыва. Пары этанола также могут легко воспламениться и представлять серьезную опасность пожара. Этанол также может быть вредным при проглатывании, а чрезмерное его употребление может привести к алкогольному отравлению. Вдыхание большого количества паров этанола может вызвать головокружение, головную боль и тошноту. Длительное воздействие этанола также может вызвать раздражение и высыхание кожи. Этанол следует хранить в прохладном, хорошо проветриваемом помещении вдали от источников возгорания и несовместимых веществ. При работе с этанолом следует использовать соответствующее защитное оборудование, такое как перчатки и защитные очки.
| Символы опасности | Ф, Си, Флам. Лик. 2 |
| Описание безопасности | Храните вдали от источников тепла, искр, открытого огня и горячих поверхностей. Курение запрещено. Используйте взрывозащищенное электрооборудование, вентиляционное и осветительное оборудование. Избегайте вдыхания паров. Надевать защитные перчатки, защитные очки. В случае возгорания: Для тушения используйте сухой химический порошок, CO2, водяной распылитель или пену. Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными правилами. |
| Идентификаторы сети | ООН1170 |
| код ТН ВЭД | 2207.10.00 |
| Класс опасности | 3 |
| Группа упаковки | II |
| Токсичность | Этанол может быть токсичным при проглатывании или вдыхании в больших количествах. Длительное воздействие также может вызвать раздражение и высыхание кожи. Хроническое употребление алкоголя может привести к алкоголизму и другим проблемам со здоровьем. |
Методы синтеза этанола
Этанол можно синтезировать различными методами, включая ферментацию, прямую гидратацию этилена и конверсию биомассы.
Ферментация является наиболее распространенным методом производства этанола и включает в себя преобразование сахаров и других углеводов в этанол микроорганизмами, такими как дрожжи. Этот процесс используется для производства этанола из таких культур, как кукуруза, ячмень и сахарный тростник, а также из отходов, таких как пищевые отходы и сельскохозяйственные отходы.
Прямая гидратация этилена — еще один метод получения этанола. В этом процессе этилен реагирует с водой в присутствии катализатора, такого как фосфорная кислота , с образованием этанола. Этот метод обычно используется в промышленных условиях и более эффективен, чем ферментация.
Конверсия биомассы — это еще один метод производства этанола, который включает в себя преобразование растительных материалов, таких как древесная щепа, травы и сельскохозяйственные отходы, в этанол. Этот процесс включает расщепление целлюлозы и гемицеллюлозы растительного материала на простые сахара, которые можно ферментировать в этанол.
Другие методы производства этанола включают каталитическую конверсию углекислого газа и электрохимическое восстановление углекислого газа.
Каждый из этих методов имеет свои преимущества и недостатки, и выбор метода зависит от таких факторов, как доступность сырья, стоимость и эффективность. Ферментация остается наиболее широко используемым методом производства этанола благодаря своей экономичности и надежности.
Использование этанола
Этанол имеет широкий спектр промышленного, коммерческого и личного использования. Некоторые из его распространенных применений включают в себя:
- Этанол повышает октановое число и снижает выбросы при использовании в качестве присадки к бензину.
- Этанол — универсальный растворитель, обычно используемый в производстве фармацевтических, косметических средств и средств личной гигиены.
- Алкогольные напитки, такие как пиво, вино и спиртные напитки, содержат этанол в качестве активного ингредиента.
- В дезинфицирующих средствах для рук, средствах для очистки поверхностей и других чистящих средствах этанол используется в качестве эффективного дезинфицирующего средства.
- Этанол используется в качестве растворителя при экстракции эфирных масел, ароматизаторов и других природных соединений.
- Производители используют этанол в качестве сырья для производства других химикатов, таких как уксусная кислота и этилен.
- В продуктах личной гигиены, таких как духи, лосьоны и средства по уходу за волосами, этанол используется в качестве консерванта и ароматизатора.
- Химические лаборатории обычно используют этанол в качестве растворителя и реагента.
- В автомобильных и других системах охлаждения в качестве антифриза может использоваться этанол.
Вопросы:
Сколько атомов составляет молекула этанола (C2H6O)?
Молекула этанола (C2H6O) состоит из 9 атомов: 2 атомов углерода, 6 атомов водорода и 1 атома кислорода.
