Хлорид алюминия или AlCl3 — химическое соединение, используемое в различных промышленных процессах. Он действует как кислота Льюиса, катализируя реакции органического синтеза и полимеризации. Он также обладает антиперспирантными свойствами в средствах личной гигиены.
| Название ИЮПАК | Трихлорид алюминия |
| Молекулярная формула | AlCl3 |
| Количество CAS | 7446-70-0 |
| Синонимы | Трихлорид алюминия, хлорид алюминия (III), хлорид алюминия (III), хлорид алюминия, трихлоралюминий |
| ИнЧИ | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Формула хлорида алюминия
Химическая формула хлорида алюминия: AlCl3. Эта формула представляет количество атомов каждого элемента в молекуле. Формула хлорида алюминия важна, поскольку она используется для идентификации вещества и расчета его свойств. Формула также используется в химических уравнениях для обозначения реагентов и продуктов химической реакции.
Молярная масса of хлорид алюминия
Хлорид алюминия имеет молярную массу 133,34 г/моль. Это значение рассчитывается путем сложения атомных масс одного атома алюминия и трех атомов хлора. Молекулярная формула хлорида алюминия — AlCl3, что означает, что он содержит один атом алюминия и три атома хлора. Молярная масса является важным свойством хлорида алюминия, поскольку он используется во многих химических реакциях и промышленных процессах. Молярная масса также используется для расчета количества вещества, присутствующего в данном образце.
Температура кипения хлорида алюминия
Температура кипения хлорида алюминия составляет 180,8°C (357,4°F). Эта величина представляет собой температуру, при которой жидкая форма хлорида алюминия переходит в газообразное состояние. Температура кипения хлорида алюминия относительно высока, что делает его полезным во многих промышленных процессах, требующих высоких температур. Например, хлорид алюминия используется в качестве катализатора при производстве полипропилена, термопластичного полимера.
Температура плавления хлорида алюминия
Температура плавления хлорида алюминия составляет 194°C (381,2°F). Эта величина представляет собой температуру, при которой твердая форма хлорида алюминия переходит в жидкое состояние. Температура плавления хлорида алюминия относительно низкая, что означает, что его легко плавить и использовать в различных химических реакциях и промышленных процессах. Например, хлорид алюминия используется в качестве коагулянта в водоочистной промышленности.
Плотность хлорида алюминия г/мл
Плотность хлорида алюминия 2,44 г/см3. Эта величина представляет собой массу хлорида алюминия в единице объема. Плотность хлорида алюминия важна, поскольку она определяет массу данного объема вещества. Плотность хлорида алюминия также используется для расчета концентрации вещества в растворе.
Структура хлорида алюминия
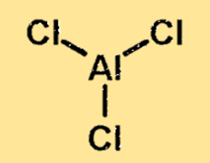
Структура хлорида алюминия представляет собой ковалентно связанную молекулу с одним атомом алюминия и тремя атомами хлора. Атом алюминия расположен в центре молекулы, окруженный тремя атомами хлора. Строение хлорида алюминия важно, поскольку оно определяет физические и химические свойства вещества.
Молекулярный вес хлорида алюминия
Молекулярная масса хлорида алюминия составляет 133,34 г/моль. Эта величина представляет собой сумму атомных весов атомов в молекуле. Молекулярная масса хлорида алюминия важна, поскольку она используется для расчета количества вещества, присутствующего в данном образце. Это значение также используется для определения молярной концентрации раствора.
| Появление | Твердое вещество или порошок от белого до желтого цвета |
| Удельный вес | 2,44 г/см3 |
| Цвет | От бесцветного до бледно-желтого |
| Запах | Без запаха |
| Молярная масса | 133,34 г/моль |
| Плотность | 2,44 г/см3 |
| Точка плавления | 194°С (381,2°Ф) |
| Точка кипения | 180,8°С (357,4°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в этаноле, метаноле и эфире. |
| Давление газа | 2,67 кПа при 25°C |
| Плотность пара | 4,45 (воздух = 1) |
| пКа | -6 |
| рН | 2,0 (10 г/л, H2O) |
Безопасность и опасность хлорида алюминия
Хлорид алюминия представляет собой ряд рисков для безопасности и здоровья. Он вызывает коррозию и может вызвать сильное раздражение кожи и глаз, а также раздражение дыхательных путей и пищеварительного тракта при проглатывании или вдыхании. Он также может вызвать ожоги при попадании на кожу. Хлорид алюминия является сильным окислителем и может бурно реагировать с водой с выделением газообразного хлористого водорода. Он также несовместим со многими органическими соединениями, такими как спирты и амины, и может вступать с ними в реакцию с образованием опасных газов. При работе с хлоридом алюминия следует использовать соответствующее защитное оборудование, включая перчатки, очки и респиратор.
| Символы опасности | Коррозионный, вредный |
| Описание безопасности | Избегайте контакта с кожей и глазами. Надевайте защитные перчатки и средства защиты глаз/лица. В случае попадания промыть большим количеством воды и обратиться к врачу. Не глотать и не вдыхать. Используйте в хорошо проветриваемом помещении. Хранить в сухом прохладном месте вдали от несовместимых материалов. |
| Идентификационные номера ООН | ООН 1726 |
| код ТН ВЭД | 2827.32.00 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | Токсично при проглатывании или вдыхании. Вызывает серьезное раздражение кожи и глаз. Может вызвать раздражение дыхательных и пищеварительных путей. Может бурно реагировать с водой с выделением газообразного хлористого водорода. Несовместим со многими органическими соединениями, такими как спирты и амины, и может вступать с ними в реакцию с образованием опасных газов. |
Методы синтеза хлорида алюминия
Хлорид алюминия можно синтезировать различными методами, такими как прямой синтез, гидролиз и реакция алюминия с хлористым водородом.
- Прямой синтез включает реакцию алюминия с газообразным хлором при высоких температурах, обычно около 700–800°C. Реакция алюминия с хлористым водородом приводит к образованию хлорида алюминия в газовой фазе, который можно конденсировать в жидкую форму.
- Гидролиз включает реакцию металлического алюминия с соляной кислотой или водой, в результате которой образуется газообразный водород и хлорид алюминия. Реакция гидролиза обычно экзотермична и может быть опасной, если ее проводить неправильно.
- Реакция алюминия с газообразным хлористым водородом — еще один метод синтеза хлорида алюминия. Эта реакция протекает при комнатной температуре и приводит к образованию газообразного водорода и хлорида алюминия.
- Другой распространенный метод синтеза хлорида алюминия — реакция оксида алюминия с соляной кислотой. В результате этой реакции в качестве продуктов образуются хлорид алюминия и вода.
- Реакция алюминия со смесью газообразного хлора и угарного газа — еще один метод синтеза хлорида алюминия. Эта реакция происходит при высоких температурах и приводит к образованию хлорида алюминия и углекислого газа.
В целом, синтез хлорида алюминия требует осторожного обращения и контроля условий реакции, чтобы обеспечить безопасный и эффективный процесс.
Использование хлорида алюминия
Хлорид алюминия имеет множество применений в различных отраслях промышленности благодаря своим уникальным свойствам.
- В реакциях органической химии, включая производство полимеров, фармацевтических препаратов и парфюмерии, в качестве катализатора обычно используется хлорид алюминия.
- Очистка питьевой воды и сточных вод от взвешенных веществ часто предполагает использование хлорида алюминия в качестве коагулянта.
- Производство алюминия и сплавов выигрывает от использования хлорида алюминия в качестве флюса, который помогает удалить примеси и улучшить процесс литья.
- В нефтехимической промышленности хлорид алюминия служит катализатором при производстве бензина и других углеводородов. Кроме того, он используется в качестве дезодоранта и антиперспиранта в средствах личной гигиены.
- В некоторых безрецептурных лекарствах используется хлорид алюминия, обладающий вяжущими свойствами, для лечения небольших раздражений кожи и остановки кровотечений. Хлорид алюминия также используется для лечения гипергидроза — состояния, характеризующегося чрезмерным потоотделением.
- В текстильной промышленности хлорид алюминия используется в качестве протравы для закрепления красителей на тканях, а также в производстве синтетического каучука.
В целом хлорид алюминия находит разнообразное и важное применение во многих отраслях промышленности, что подчеркивает его важность в современном мире.
Вопросы:
Вопрос: Что лучше всего сравнивает 1 моль хлорида натрия с 1 молем хлорида алюминия?
Ответ: 1 моль хлорида натрия (NaCl) и 1 моль хлорида алюминия (AlCl3) содержат по 1 молю ионов хлорида, но хлорид алюминия содержит в три раза больше катионов, чем хлорид натрия.
Вопрос: Является ли хлорид алюминия водным?
Ответ: Хлорид алюминия может существовать в твердой и водной формах. При растворении в воде образует очень кислый раствор из-за гидролиза катиона алюминия.
Вопрос: Какова правильная формула хлорида алюминия?
Ответ: Правильная формула хлорида алюминия — AlCl3. Это указывает на то, что каждая молекула хлорида алюминия содержит один катион алюминия (Al3+) и три хлорид-аниона (Cl-).
Вопрос: Безопасен ли хлорид алюминия?
Ответ: Хлорид алюминия может быть опасен при неправильном обращении. Он может вызвать раздражение кожи и глаз, раздражение дыхательных путей и пищеварительного тракта, а также может быть токсичным при проглатывании или вдыхании. Его следует хранить и обращаться с ним в хорошо проветриваемом помещении и с использованием соответствующего защитного оборудования.
Вопрос: Сколько ионов хлора содержится в 1,50 молях хлорида алюминия?
Ответ: Поскольку формула хлорида алюминия — AlCl3, каждая молекула содержит три иона хлорида. Следовательно, в 1,50 молях хлорида алюминия содержится 1,50 х 3 = 4,50 молей хлорид-ионов.
