Персульфат аммония ((NH4)2S2O8) представляет собой белый порошок. Он растворяется в воде и выделяет кислород. Он может отбеливать, протравливать или инициировать полимеризацию.
| Название ИЮПАК | Пероксидисульфат аммония |
| Молекулярная формула | (NH4)2S2O8 |
| Количество CAS | 7727-54-0 |
| Синонимы | Персульфат аммония, пероксодисульфат аммония, персульфат диаммония, пероксидисульфат диаммония |
| ИнЧИ | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Свойства персульфата аммония
Формула персульфата аммония
Формула персульфата аммония: (NH4)2S2O8. Он состоит из двух катионов аммония (NH4+) и одного персульфат-аниона (S2O82-). Персульфат-анион имеет две сульфатные группы (SO42-), соединенные пероксидной связью (OO).
Молярная масса персульфата аммония
Молярная масса (NH4)2S2O8 составляет 228,18 г/моль. Это рассчитывается путем сложения атомных масс всех атомов в формуле: 2 х 14,01 (N) + 8 х 1,01 (H) + 2 х 32,06 (S) + 8 х 16,00 (О).
Температура кипения персульфата аммония
(NH4)2S2O8 не имеет точки кипения, поскольку разлагается до достижения этой температуры. Он разлагается примерно при 120°C (248°F) на аммиак, азот, кислород и воду. Реакция разложения:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Температура плавления персульфата аммония
(NH4)2S2O8 не имеет температуры плавления, поскольку разлагается до достижения этой температуры. Он разлагается примерно при 120°C (248°F) на аммиак, азот, кислород и воду. Реакция разложения:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Плотность персульфата аммония г/мл
Плотность (NH4)2S2O8 составляет 1,98 г/мл при 25°С. Это означает, что один миллилитр (NH4)2S2O8 весит 1,98 грамма.
Молекулярный вес персульфата аммония
Молекулярная масса (NH4)2S2O8 равна его молярной массе, которая составляет 228,18 г/моль. Это означает, что один моль (NH4)2S2O8 весит 228,18 грамма.
Структура персульфата аммония
Строение (NH4)2S2O8 можно представить следующей структурой Льюиса:
оо
|| ||
О=С||-ООС||=О
|| ||
оо
/\
НХ НХ
\/
ЧАС
/\
НХ НХ
\/
ЧАС
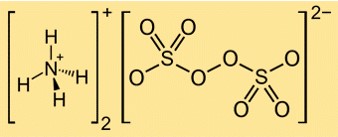
В этой структуре каждый атом серы связан с четырьмя атомами кислорода в тетраэдрической геометрии, и каждый атом кислорода имеет две пары свободных электронов. Пероксидная связь между двумя сульфатными группами представляет собой одинарную связь с одной парой электронов. Катионы аммония образуются из атомов азота, имеющих три электрона с тремя атомами водорода каждый и имеющих положительный заряд.
Растворимость персульфата аммония
(NH4)2S2O8 хорошо растворим в воде, гораздо лучше, чем связанная с ним калиевая соль 1 . Он растворяется в воде с образованием ионов аммония и персульфат-ионов, которые в дальнейшем могут диссоциировать на сульфатные радикалы:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
Растворимость (NH4)2S2O8 в воде увеличивается с повышением температуры. При температуре 25°C он растворяет до 80 г/100 мл воды. Он также умеренно растворим в метаноле.
| Появление | Кристаллы от белого до желтоватого цвета |
| Удельная плотность | 1,98 |
| Цвет | От белого до желтоватого |
| Запах | Сладкий и неприятный |
| Молярная масса | 228,18 г/моль |
| Плотность | 1,98 г/мл при 25°C |
| Точка плавления | 120°C (разлагается) |
| Точка кипения | Н/Д (разложено) |
| Мигающая точка | Н/Д |
| Растворимость в воде | 80 г/100 мл при 25°C |
| Растворимость | Умеренно растворим в MeOH |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Н/Д |
Безопасность и опасность персульфата аммония
(NH4)2S2O8 — сильный окислитель, способный усиливать пожар и взрывоопасно реагировать с горючими материалами. Он также может вызвать различные последствия для здоровья при проглатывании, вдыхании или попадании на кожу или в глаза. Он может раздражать кожу, глаза, нос, горло и легкие. Это также может вызвать аллергические реакции, такие как сыпь, астма или затрудненное дыхание. Это вредно для водных обитателей. Поэтому с ним следует обращаться осторожно и использовать соответствующие защитные средства. Его следует хранить вдали от источников тепла, искр, пламени и других несовместимых веществ.
| Символы опасности | O (окислитель), Xn (вредный), Xi (раздражитель) |
| Описание безопасности | S17 (Беречь от горючих материалов), S26 (При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу), S36/37/39 (Надевать соответствующую защитную одежду, перчатки и средства защиты глаз/лица), S45 (В случае несчастного случая или плохого самочувствия немедленно обратитесь за медицинской помощью) |
| Идентификационные номера ООН | ООН 1444 |
| код ТН ВЭД | 28334000 |
| Класс опасности | 5.1 (Окисляющие материалы) |
| Группа упаковки | III |
| Токсичность | Перорально LD50, крыса: 689 мг/кг, LC50, ингаляционно, крыса: 2,95 мг/л/4 часа, кожная LD50, крыса: 2000 мг/кг. |
Методы синтеза персульфата аммония
Для получения (NH4)2S2O8, неорганической соли, можно использовать различные методы.
Один из наиболее распространенных методов включает электролиз холодного концентрированного раствора сульфата аммония ((NH4)2SO4) и серной кислоты (H2SO4) .
Этот метод был впервые описан Хью Маршаллом. Электролиз включает пропускание электрического тока через раствор с использованием платинового анода и пористого серебряного катода.
На аноде в результате электролиза серной кислоты образуются ионы гидросульфата HSO4-, которые в сочетании с водой образуют персульфат-ионы S2O82- и газообразный водород H2. На катоде газообразный кислород O2 восстанавливается с образованием перекиси водорода H2O2, которая реагирует с ионами аммония NH4+ с образованием (NH4)2S2O8 (NH4)2S2O8 и воды H2O.
Общая реакция следующая:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
При охлаждении и фильтровании (NH4)2S2O8 можно кристаллизовать из раствора электролита.
Другой метод получения (NH4)2S2O8 — окисление бисульфата аммония NH4HSO4 озоном O3 или перекисью водорода H2O2 . Этот метод дает более высокий выход и чистоту (NH4)2S2O8, чем метод электролиза. Реакция:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Золото
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Применение персульфата аммония
(NH4)2S2O8 — универсальное химическое вещество, которое находит множество применений в различных отраслях промышленности и применениях. Некоторые из наиболее распространенных вариантов использования:
- Он служит отбеливающим агентом и химическим предшественником при синтезе других промышленно важных соединений.
- Он инициирует процесс полимеризации и производители в основном используют его при производстве полистирола.
- Производители печатных плат используют его в качестве травителя для удаления меди и других металлов с поверхности.
- Полупроводниковая промышленность также использует (NH4)2S2O8 в качестве травителя для очистки и полировки кремниевых пластин.
- В лабораториях его используют в качестве чистящего и дезинфицирующего средства для оборудования, стеклянной посуды и систем водоснабжения.
- Он предотвращает потемнение фруктов и овощей, что делает его добавкой, используемой для консервирования продуктов.
- В различных химических реакциях его используют в качестве окислителя для синтеза органических пероксидов, сульфонов и сульфаниламидов.
- Батареи используют его в качестве деполяризатора для увеличения производительности и срока службы.
- В отбеливателях для волос он используется в качестве обычного ингредиента для осветления цвета волос за счет окисления пигмента меланина.
Вопросы:
Вопрос: Как долго действует персульфат аммония?
Ответ: (NH4)2S2O8 — стабильное соединение, которое может храниться неопределенно долго в твердом состоянии без разложения. Однако со временем он может потерять свою эффективность при растворении в воде. Срок хранения 10% раствора (NH4)2S2O8 составляет примерно 2–4 недели при комнатной температуре и 2–3 месяца при 4°C 1 2 . Раствор следует защищать от света и тепла и периодически проверять на наличие пузырьков или осадков, указывающих на разложение.
Вопрос: Что делает персульфат аммония?
A: (NH4)2S2O8 является сильным окислителем, который может выделять радикалы кислорода в водном растворе. Эти радикалы могут запускать или ускорять различные химические реакции, такие как полимеризация, отбеливание, травление, очистка и дезинфекция. (NH4)2S2O8 также может выступать источником сульфат-ионов для синтеза других соединений.
Вопрос: С чем смешивать персульфат аммония?
Ответ: (NH4)2S2O8 хорошо растворим в воде и может смешиваться с водой для приготовления растворов различной концентрации. Растворимость (NH4)2S2O8 в воде увеличивается с повышением температуры. При температуре 25°C он растворяет до 80 г/100 мл воды. Он также умеренно растворим в метаноле. (NH4)2S2O8 не следует смешивать с несовместимыми веществами, такими как горючие материалы, восстановители, металлы, кислоты или основания, поскольку он может вступать с ними в бурную или взрывоопасную реакцию.
Вопрос: Пероксидисульфат аммония — это то же самое, что персульфат аммония?
Ответ: Да, пероксидисульфат аммония — это другое название (NH4)2S2O8. Оба они являются синонимами одного и того же соединения с формулой (NH4)2S2O8.
Вопрос: Для чего используется персульфат аммония в SDS-PAGE?
Ответ: SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) — это метод разделения белков в зависимости от их размера и заряда. (NH4)2S2O8 используется в качестве катализатора полимеризации мономеров акриламида и бисакриламида с образованием матрицы полиакриламидного геля. (NH4)2S2O8 генерирует свободные радикалы, которые инициируют реакцию сшивки между мономерами.
Вопрос: Как сделать 10% персульфат аммония?
Ответ: Чтобы приготовить 10% раствор (NH4)2S2O8, взвесьте 10 г твердого вещества (NH4)2S2O8 и растворите его в 90 мл дистиллированной воды. Перемешать до полного растворения и перелить в мерную колбу вместимостью 100 мл. Залейте до метки дистиллированной водой и хорошо перемешайте. Храните раствор в темной бутылке при температуре 4°C или комнатной температуре.
Вопрос: Как отремонтировать персульфат аммония, вызванный дугой?
Ответ: Дуговая вспышка – это дефект, вызванный электрической дугой, повреждающей поверхность металла. Это может снизить прочность и коррозионную стойкость металла и привести к растрескиванию или выходу из строя. Чтобы устранить вспышку дуги, одним из методов является использование (NH4)2S2O8 в качестве травителя для удаления пораженного участка. Процедура следующая:
- Очистите металлическую поверхность ацетоном или спиртом, чтобы удалить грязь и жир.
- Нанесите кистью или ватной палочкой на место зажигания дуги тонкий слой раствора персульфата аммония (10-20%).
- Подождите 5–10 минут, пока на поверхности не появятся пузырьки, указывающие на то, что происходит реакция окисления.
- Промойте поверхность водой и высушите чистой тканью.
- Повторяйте процедуру до тех пор, пока дуга не исчезнет полностью.
- Осмотрите поверхность на наличие трещин и ямок и при необходимости заполните их соответствующим наполнителем.
- Нанесите защитное покрытие или краску, чтобы предотвратить дальнейшую коррозию.
Вопрос: Является ли персульфат аммония поверхностно-активным веществом?
О: Нет, (NH4)2S2O8 не является поверхностно-активным веществом. Поверхностно-активное вещество — это вещество, которое уменьшает поверхностное натяжение жидкости или между двумя жидкостями и может образовывать мицеллы или эмульсии. (NH4)2S2O8 такими свойствами не обладает. Это окислитель, который может выделять радикалы кислорода в водном растворе.
Вопрос: Какие аспекты вашего эксперимента контролируются TEMED и персульфатом аммония?
A: TEMED и (NH4)2S2O8 используются для контроля полимеризации мономеров акриламида и бисакриламида с образованием матрицы полиакриламидного геля для электрофореза. TEMED и (NH4)2S2O8 действуют как катализаторы, генерирующие свободные радикалы, которые инициируют и ускоряют реакцию сшивки между мономерами. Концентрация и соотношение ТЕМЕД и (NH4)2S2O8 влияют на скорость и полноту полимеризации, а также на размер пор и механическую прочность геля.
Вопрос: Вступает ли персульфат аммония в реакцию с воздухом?
О: Да, (NH4)2S2O8 может вступать в реакцию с воздухом, особенно во влажных условиях. (NH4)2S2O8 способен поглощать влагу из воздуха и подвергаться гидролизу с образованием сульфата аммония и перекиси водорода. Перекись водорода может далее распадаться на воду и газообразный кислород, выделяя тепло и давление. Это может привести к разрыву или взрыву контейнера (NH4)2S2O8, если из него не будет обеспечена надлежащая вентиляция. (NH4)2S2O8 также может вступать в реакцию с кислородом воздуха с образованием озона, который является токсичным газом. Поэтому (NH4)2S2O8 следует хранить в прохладном, сухом, хорошо проветриваемом помещении, вдали от источников тепла, искр, пламени и других несовместимых веществ.
