1-Бутанол (C4H9OH) — бесцветный спирт со слегка сладковатым запахом. Он используется в качестве растворителя, в органическом синтезе и в качестве источника топлива. Его также можно использовать в косметических продуктах и средствах личной гигиены.
| Название ИЮПАК | Бутан-1-ол |
| Молекулярная формула | C4H10O |
| Количество CAS | 71-36-3 |
| Синонимы | н-бутиловый спирт, бутанол, бутиловый спирт, 1-бутиловый спирт, 1-бутанол, бутанолен, гидрат бутилена, гидрат бутила |
| ИнЧИ | ИнЧИ=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Свойства 1-бутанола
Формула 1-бутанол
Молекулярная формула 1-бутанола — C4H10O. Это означает, что он содержит четыре атома углерода, десять атомов водорода и один атом кислорода. Он имеет линейную структуру с гидроксильной группой (-ОН), присоединенной к первому атому углерода.
1-бутанол Молярная масса
Молярная масса C4H9OH составляет 74,12 г/моль. Это означает, что один моль C4H9OH весит 74,12 грамма. Молярная масса — важное свойство вещества, поскольку оно помогает определить количество вещества, присутствующего в данном образце.
Температура кипения 1-бутанола
C4H9OH имеет температуру кипения 117,7°C (243,9°F). Это означает, что при этой температуре он превратится из жидкости в газ. Температура кипения C4H9OH выше, чем у этанола, из-за наличия дополнительного атома углерода.
Точка плавления 1-бутанола
Температура плавления C4H9OH составляет -90,6°C (-131,1°F). Это означает, что при этой температуре он изменится из твердого состояния в жидкое. Температура плавления C4H9OH ниже, чем у бутановой кислоты, имеющей аналогичную молекулярную массу.
1-бутанол Плотность г/мл
Плотность C4H9OH составляет 0,81 г/мл. Это означает, что один миллилитр C4H9OH весит 0,81 грамма. Плотность C4H9OH ниже, чем у воды, плотность которой составляет 1 г/мл.
1-бутанол Молекулярный вес
Молекулярная масса C4H9OH составляет 74,12 г/моль. Это сумма атомных весов всех атомов в его молекулярной формуле. Молекулярный вес — важное свойство вещества, поскольку оно помогает определить его физические и химические свойства.
Структура 1-бутанола
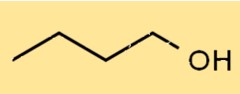
Структура C4H9OH представляет собой спирт с прямой цепью, гидроксильная группа (-OH) которой присоединена к первому атому углерода. Он имеет линейную структуру с четырьмя атомами углерода, десятью атомами водорода и одним атомом кислорода. Его структура позволяет ему образовывать водородные связи с другими молекулами.
Растворимость 1-бутанола
C4H9OH растворим в воде и органических растворителях. Его растворимость в воде снижается с повышением температуры. Он также растворим в полярных растворителях, таких как этанол и метанол. Растворимость C4H9OH в органических растворителях, таких как бензол и эфир, выше, чем в воде. Это делает его полезным в качестве растворителя в органическом синтезе.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,810 г/мл при 25°C |
| Цвет | Бесцветный |
| Запах | Немного сладкий |
| Молярная масса | 74,12 г/моль |
| Плотность | 0,81 г/мл |
| Точка плавления | -90,6°C (-131,1°F) |
| Точка кипения | 117,7°С (243,9°Ф) |
| Мигающая точка | 35°С (95°Ф) |
| Растворимость в воде | 79 г/л при 20°C |
| Растворимость | Растворим в этаноле, диэтиловом эфире, ацетоне, бензоле, хлороформе. |
| Давление газа | 1,16 кПа при 20°C |
| Плотность пара | 2,55 (относительно воздуха) |
| пКа | 16.06 |
| рН | Нейтральный (7) |
1-Безопасность и опасность бутанола
C4H9OH представляет несколько рисков для безопасности, поэтому крайне важно обращаться с ним осторожно. Это легковоспламеняющаяся жидкость, которая может легко воспламениться при воздействии тепла или искр. Он также выделяет вредные пары, которые могут вызвать раздражение и повреждение глаз, дыхательной системы и кожи. При проглатывании он может вызвать серьезные проблемы со здоровьем, включая головокружение, спутанность сознания и даже кому. Поэтому при работе с C4H9OH необходимо носить защитное оборудование, такое как перчатки, очки и респираторы. При попадании на кожу или в глаза промойте водой и немедленно обратитесь к врачу. Надлежащее хранение, обращение и утилизация C4H9OH необходимы для предотвращения несчастных случаев и обеспечения безопасности.
| Символы опасности | Ф, Си |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Надевайте защитные перчатки/защиту глаз/лица. ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): Немедленно снимите всю загрязненную одежду. Промойте кожу водой/душем. ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание. Хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых веществ. |
| Идентификационные номера ООН | ООН 1120 |
| код ТН ВЭД | 2905.16.00 |
| Класс опасности | 3 |
| Группа упаковки | III |
| Токсичность | LD50 (перорально, крыса) 2,46 г/кг; LC50 (ингаляционно, крыса) 37 800 частей на миллион/4 часа |
Методы синтеза 1-бутанола
C4H9OH можно синтезировать несколькими методами, включая восстановление бутиральдегида, оксообработку или ферментацию.
Ферментация — распространенный метод получения C4H9OH из биомассы. В процессе ферментации такие микроорганизмы, как Clostridium acetobutylicum, отвечают за производство смеси органических кислот и спиртов, включая C4H9OH, путем ферментации сахаров, крахмала или целлюлозы.
Оксо-процесс, также известный как гидроформилирование, включает реакцию пропена с окисью углерода и водородом в присутствии катализатора, такого как кобальт или родий. При гидрировании бутиральдегида образуется C4H9OH. При гидрировании бутиральдегида образуется соединение C4H9OH.
Другой метод синтеза C4H9OH включает восстановление бутиральдегида водородом в присутствии такого катализатора, как палладий или никель. В результате этой реакции образуется C4H9OH с водой в качестве побочного продукта.
Процесс Фишера-Тропша — это метод получения C4H9OH из ископаемого топлива. Это предполагает использование катализатора, вызывающего реакцию монооксида углерода и водорода, что приводит к образованию различных углеводородов, включая C4H9OH.
Использование 1-бутанола
C4H9OH имеет множество применений в различных отраслях промышленности благодаря своим уникальным свойствам. Некоторые распространенные варианты использования C4H9OH включают:
- Растворитель: используется в качестве растворителя для различных веществ, включая смолы, жиры, масла и воски.
- Промежуточное соединение: используется в качестве промежуточного продукта при производстве других химических веществ, таких как бутилакрилат и бутилацетат.
- Присадка: используется в качестве присадки к бензину и дизельному топливу для повышения октанового числа и снижения выбросов.
- Экстрагент: используется в качестве экстрагента при производстве антибиотиков, витаминов и гормонов.
- Косметические средства и средства личной гигиены: используются при производстве различных косметических средств и средств личной гигиены, включая лосьоны, кремы и парфюмерию.
- Ароматизаторы и ароматизаторы: Используется в качестве усилителя вкуса и аромата в пищевой промышленности и производстве напитков.
- Фармацевтика: используется при производстве различных фармацевтических продуктов, включая седативные и снотворные средства.
- Пестициды: используются в качестве компонента при производстве различных пестицидов и гербицидов.
Вопросы:
Вопрос: Полярен ли бутанол?
Ответ: Да, бутанол полярен из-за присутствия гидроксильной группы (-ОН), которая придает ему дипольный момент.
Вопрос: Растворим ли 1-бутанол в воде?
Ответ: Да, C4H9OH частично растворим в воде из-за наличия гидроксильной группы, которая позволяет ему образовывать водородные связи с молекулами воды.
Вопрос: Имеет ли 1-бутанол водородную связь?
Ответ: Да, C4H9OH имеет водородную связь из-за присутствия гидроксильной группы (-OH), которая может образовывать водородные связи с другими молекулами C4H9OH или с молекулами воды.
Вопрос: Сколько мл 1-бутанола необходимо для приготовления 725 мл 0,350 мл водного раствора этого растворенного вещества?
A: Для расчета необходима молярная масса C4H9OH, равная 74,12 г/моль. Для приготовления 0,350 М раствора C4H9OH необходимо 26,12 г C4H9OH. Используя формулу: моли = концентрация х объем, мы можем рассчитать необходимый объем C4H9OH следующим образом: объем = моли / концентрация. Таким образом, объем C4H9OH, необходимый для приготовления 725 мл 0,350 мл раствора, равен (26,12/0,350) = 74,6 мл.
Вопрос: Какой спирт будет вести себя больше всего как вода? c2h5oh c4h9oh c10h21oh c7h15oh
Ответ: Из приведенных вариантов этанол (C2H5OH) будет вести себя наиболее похоже на воду из-за небольшого размера молекулы и наличия гидроксильной группы (-OH), которая позволяет ему образовывать прочные водородные связи с молекулами воды.
Вопрос: Каковы продукты сбалансированного уравнения сгорания c4h9oh?
A: Сбалансированное уравнение горения C4H9OH: C4H9OH + 6O2 → 4CO2 + 5H2O. Продуктами реакции являются углекислый газ (CO2) и вода (H2O).
Вопрос: Какова молярная масса бутанола (c4h9oh)?
A: Молярная масса бутанола (C4H9OH) составляет 74,12 г/моль.
Вопрос: Есть ли у C4h9oh водородная связь?
Ответ: Да, C4H9OH имеет водородную связь благодаря наличию гидроксильной группы (-OH), которая позволяет ему образовывать водородные связи с другими молекулами C4H9OH или с молекулами воды.
Вопрос: Сколько граммов бутилового спирта (c4h9oh) содержится в растворе объемом 2500 мл или 2,22 м?
Ответ: Чтобы рассчитать количество граммов бутилового спирта в растворе, нам нужно воспользоваться формулой: моли = концентрация х объем. Концентрация раствора составляет 2,22 моль/л, а объем — 2,5 л (2500 мл в пересчете на л). Итак, количество молей бутилового спирта в растворе равно: 2,22 х 2,5 = 5,55 моль. Чтобы рассчитать массу бутилового спирта, умножьте количество молей на его молярную массу (74,12 г/моль): 5,55 х 74,12 = 411,4 г. Следовательно, в растворе объемом 2500 мл содержится 411,4 грамма бутилового спирта, или 2,22 М.
